
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дисперсные системы. Виды дисп. Систем
|
|
|
|
Химическое равновесие. Принцип Ле-шателье. Факторы, влияющие на смещение химического равновесия
Химическое равновесие - состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. А2 + В2 ⇄ 2AB
Принцип Ле Шателье. (1884 г.) - если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации.
Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t↑ →, t↓ ←
N2+3H2↔2NH3 +Q t↑ ←, t↓ →
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ →
1моль=1моль+1моль
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при повышении концентрации продуктов реакции-в сторону исходных веществ.
S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ←
Катализаторы не влияют на смещение химического равновесия!
ДИСПЕРСНЫЕ СИСТЕМЫ, состоят из твердых частиц, капель или пузырьков газа (дисперсная фаза), распределенных в какой-либо среде (дисперсионная среда). Основные виды дисперсных систем: аэрозоли, суспензии, эмульсии, золи, гели, порошки, волокнистые материалы типа войлока, пены, латексы, композиты, микропористые материалы; в природе - горные породы, почвы, атмосферные осадки. Важнейшие свойства дисперсных систем определяются поверхностными явлениями на границе раздела фаз; их изучает коллоидная химия.
В природе не существует абсолютно чистых веществ. Даже те вещества, которые мы считаем чистыми, всегда содержат хотя бы небольшое количество примесей. Наличие примесей порой очень сильно меняет свойства веществ. Например, железо с очень низким содержанием примесей ("особо чистое" железо) - мягкий и ковкий металл, который практически не подвергается коррозии, но в виде тонкораздробленного порошка самовозгорается на воздухе. В то же время сталь - однородный сплав железа с углеродом - это твердое, упругое, легко ржавеющее во влажном воздухе вещество, загорающееся лишь при нагревании выше 1500 °С.
Смеси веществ по степени дисперсности (дисперсность - характеристика размеров частиц данного вещества) условно разделяют на грубодисперсные, или механические смеси (размер частиц свыше 100 нм ), коллоидные растворы (размер частиц 1-100 нм) и истинные растворы, размер частиц которых определяется размером ионов и молекул.
Механические смеси (взвеси) и коллоидные растворы являются многофазными (гетерогенными) системами, в которых частицы одного или нескольких веществ распределены в какой-либо среде. Механические смеси в зависимости от агрегатного состояния среды и распределенных в ней других веществ имеют свои особые названия: суспензия, эмульсия, аэрозоль, пена.
Суспензия - взвесь частиц одного или нескольких твердых веществ в жидкой среде. Обычно твердые частицы настолько велики, что они постепенно оседают под действием силы тяжести. Размеры взвешенных частиц суспензий более 1000 нанометров (1 нм = 1 · 10−9 м). Устойчивые суспензии образуются в тех случаях, когда плотности твердой и жидкой фаз почти не различаются или на твердых частицах адсорбируются полярные молекулы жидкой фазы или ионы растворенных веществ. Одноименно заряженные твердые частицы при своем движении уже не сталкиваются и не слипаются. Примеры суспензии - известковое молоко, гуашевые краски и другие краски, содержащие минеральные пигменты, фруктовый сок с мякотью и т.д.
Эмульсия - взвесь капель одной или нескольких жидких фаз в среде другой по составу жидкой фазы. Эмульсии со временем разрушаются, капли при соприкосновении друг с другом сливаются, и система постепенно расслаивается снова на несмешивающиеся жидкости. Широко известные примеры эмульсий - молоко (капельки жира в воде), водно-эмульсионные (латексные) краски, а также косметические кремы, лекарственные мази, бытовые хозяйственные препараты.
Аэрозоли - взвесь жидких или твердых частиц в газообразной среде. К аэрозолям относятся туман, дым и пыль. Наиболее мелкие частицы (менее 100 нм) содержатся в дыме. Частицы твердых веществ в аэрозолях часто несут определенный заряд: оксиды металлов (Fe2O3, MgO, ZnO, Cr2O3 и др.) образуют отрицательно заряженную пыль, а кислотные оксиды и неметаллы (SiO2, C, S8, TiO2 и др.) - положительно заряженную.
Пены о бразуются при распределении пузырьков газа в жидкой или твердой среде. Такие примеры этого явления, как образование мыльной пены, хорошо известны. При включении пузырьков газа, частиц жидкого вещества или твердой примеcи в твердую основу мы наблюдаем окклюзию (пример - пенопласт).
Коллоидные растворы - системы, включающие среду, где распределены очень мелкие (микрогетерогенные) частицы, участвующие в интенсивном беспорядочном движении. Это явление (броуновское движение) открыл английский ученый, ботаник Р. Броун (1773-1858). В коллоидном растворе взвешенные частицы равномерно распределены по объему и очень медленно осаждаются (коагулируют). В качестве примера коллоидного раствора можно привести раствор серы в воде, образующийся сразу после смешения сероводородной воды с небольшим количеством хлорной воды.
Истинные растворы - это однофазные (гомогенные) системы переменного состава, содержащие атомы, ионы или молекулы и состоящие из них небольшие устойчивые группы (ассоциаты). Истинные растворы могут быть газообразными (смесь газов в атмосфере Земли, состоящая из азота, кислорода, диоксида углерода, аргона и других газов, азотоводородная смесь в промышленном синтезе аммиака и др.), жидкими (морская вода - раствор хлорида натрия, сульфата натрия и других солей в воде, нефть - смесь углеводородов и др.) и твердыми (сплавы металлов, минералы и т.п.).
20. Растворение как физико-химический процесс. Растворы. Способы выражения концентрации растворов: массовая доля, молярная концентрация, нормальность, титр
Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты - в зависимости от природы вещества. В результате химического взаимодействия растворенного вещества с растворителем образуются соединения, которые называют сольватами (или гидратами, если растворителем является вода). Образование таких соединений роднит растворы с химическими соединениями.
Особенно склонны к гидратации (соединению с водой) ионы. Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы; поэтому, например, в растворе ион меди (II) голубой, в безводном сульфате меди он бесцветный. Многие из таких соединений непрочны и легко разлагаются при выделении их в свободном виде, однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора кристаллизацией. При этом выпадают кристаллы, содержащие молекулы воды. Кристаллические вещества, содержащие молекулы воды, называютя кристаллогидратами, а вода, входящая в состав кристаллогидратов, называется кристаллизационной. Кристаллогидратами являются многие природные минералы. Ряд веществ (в том числе и органические) получаются в чистом виде только в форме кристаллогидратов. Д.И. Менделеев доказал существование гидратов серной кислоты, а также ряда других веществ.
Таким образом, растворение - не только физический, но и химический процесс.
Растворы - однофазные системы, состоящие из двух или более компонентов. По своему агрегатному состоянию растворы могут быть твердыми, жидкими или газообразными. Так, воздух - это газообразный раствор, гомогенная смесь газов; водка - жидкий раствор, смесь нескольких веществ, образующих одну жидкую фазу; морская вода - жидкий раствор, смесь твердого (соль) и жидкого (вода) веществ, образующих одну жидкую фазу; латунь - твердый раствор, смесь двух твердых веществ (меди и цинка), образующих одну твердую фазу. Смесь бензина и воды не является раствором, поскольку эти жидкости не растворяются друг в друге, оставаясь в виде двух жидких фаз с границей раздела. Компоненты растворов сохраняют свои уникальные свойства и не вступают в химические реакции между собой с образованием новых соединений. Так, при смешивании двух объемов водорода с одним объемом кислорода получается газообразный раствор. Если эту газовую смесь поджечь, то образуется новое вещество - вода, которая сама по себе раствором не является. Компонент, присутствующий в растворе в большем количестве, принято называть растворителем, остальные компоненты - растворенными веществами.
Однако иногда бывает трудно провести грань между физическим перемешиванием веществ и их химическим взаимодействием. Например, при смешивании газообразного хлороводорода HCl с водой H2O образуются ионы H3O+ и Cl-. Они притягивают к себе соседние молекулы воды, образуя гидраты. Таким образом, исходные компоненты - HCl и H2O - после смешивания претерпевают существенные изменения. Тем не менее ионизация и гидратация (в общем случае - сольватация) рассматриваются как физические процессы, происходящие при образовании растворов. Одним из важнейших типов смесей, представляющих собой гомогенную фазу, являются коллоидные растворы: гели, золи, эмульсии и аэрозоли
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
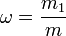 ,
,
где:
· m1 — масса растворённого вещества, г;
· m — общая масса раствора, г.
Массовое процентное содержание компонента, m%
m%=(mi/Σmi)*100
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации 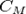 , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным. Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» ттт и т. д.
, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным. Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» ттт и т. д.
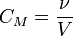 ,где:
,где:
· ν — количество растворённого вещества, моль;
· V — общий объём раствора, л.
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
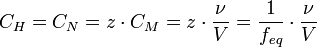 ,
,
где:
· ν — количество растворённого вещества, моль;
· V — общий объём раствора, л;
· z — число эквивалентности (фактор эквивалентности  ).
).
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованиемгидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Молярность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным. 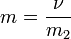 , где:
, где:
· ν — количество растворённого вещества, моль;
· m2 — масса растворителя, кг.
Следует обратить особое внимание, что несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Титр раствора — масса растворённого вещества в 1 мл раствора.
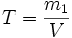 , где:
, где:
· m1 — масса растворённого вещества, г;
· V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
21. Окислительно-восстановительные реакции. Типы окисл.-восст.реакций – Составление уравнений овр: метод электронного баланса, ионно-электронный метод
Окисли́тельно-восстанови́тельные реа́кции — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например: 2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например: Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
Метод электронного баланса. В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом:число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем.
Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов.
Пример. Составление уравнения реакции меди с раствором нитрата палладия (II).Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления:
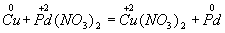
Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь - восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия (II) -окислитель. Эти изменения можно выразить электронными уравнениями
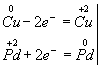

из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции:
Cu + Pd(NO3)2 = Cu(NO3)2 + Pd
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Pd2+ + 2NO3- = Cu2+ + 2NO3- + Рd
И после сокращения одинаковых ионов получим
Cu + Pd2+ = Cu2+ + Pd
Метод полуреакций или метод ионно-электронного баланса применяют при составлении уравнений сложных реакций, протекающих в водных растворах или расплавах. Стехиометрические коэффициенты находят при составлении схемы полуреакций для процессов окисления и восстановления. В методе ЭБ записываются только атомы, которые меняют свои степени окисления. Для составления записи используют реальные частицы – атомы, молекулы, ионы, а также частицы, характеризующие среду (кислую – Н+, щелочную – ОН-, нейтральную – H2O). Сильные электролиты записывают в виде ионов, а слабые электролиты, газообразные вещества и труднорастворимые соединения – в виде молекул.
При нахождении коэффициентов в уравнении реакции руководствуются правилами:
- Если исходные вещества содержат большее число атомов кислорода, чем полученные продукты, то освобождающийся кислород в кислой среде с ионами водорода образует воду, а в нейтральной и щелочной средах с молекулами воды – гидроксид-ионы.
- Если исходные вещества содержат меньшее число атомов кислорода, чем образующиеся, то недостающее число атомов кислорода восполняется в кислой и нейтральной средах за счет молекул воды, а в щелочной – за счет ионов ОН-: Пример.
Составьте уравнение реакции Na2SO3 + KMnO4 + H2SO4 → с помощью метода полуреакций (ионно-электронного метода).
Решение: Для составления уравнения реакции воспользуемся следующим алгоритмом:
1. Определим вещество, которое является окислителем и восстановителем. Сульфит натрия в растворе образует ион SO32–, в котором атом серы находится в промежуточной степени окисления +4. Перманганат калия образует ион MnO4-, в котором марганец находится в своей высшей степени окисления +7. Поэтому SO32– – восстановитель, а MnO4- – окислитель, H2SO4 (точнее ионы Н+)- средообразователь.
2. Составим полуреакцию процесса восстановления, учитывая, что в кислой среде ион MnO4- восстанавливается окисляется до Mn2+:
MnO4- + H+ → Mn2+
Избыточный кислород содержащийся в MnO4-связывается ионами водорода с образованием молекулы воды. Чтобы связать 4 атома кислорода, потребуется 8 ионов H+ и в результате образуется 4 молекулыH2O.
MnO4- + 8H+ → Mn2+ + 4H2O
Необходимо проверить, соответствует ли число атомов каждого элемента (Mn, H, O) в правой части числу атомов каждого элемента в левой части полуреакции.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1134; Нарушение авторских прав?; Мы поможем в написании вашей работы!