
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация воды. Ионное произведение воды рН и рОН растворов
|
|
|
|
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде (ниже под диссоциацией подразумевается электролитическая диссоциация - распад на ионы): H2O ↔ H+ + OH-
Примерно на 556 000 000 не диссоциированных молекул воды диссоциирует только 1 молекула, однако это 60 000 000 000 диссоциированных молекул в 1мм3. Диссоциация обратима, то есть ионы H+ и OH- могут снова образовать молекулу воды. В итоге наступает динамическое равновесие при котором количество распавшихся молекул равно количеству образовавшихся из H+ и OH- ионов. Другими словами скорости обоих процессов будут равны. Для нашего случая, уравнение скорости химической реакции можно написать так:
υ1 = κ1 • [H2O] (для диссоциации воды)
υ2 = κ2 • [H+] • [HO-] (для обратного процесса)
где υ - скорость реакции; κ - константа скорости реакции (зависящая от природы реагирующих веществ и температуры); [H2O], [H+] и [HO-] - концентрации (моль/л).
В состоянии равновесия υ1 = υ2, следовательно: κ1 • [H2O] = κ2 • [H+] • [HO-]
Так как, при определенной температуре, величины используемые в расчете ионного произведения воды (K, [H2O]) постоянны, значение ионного произведения воды [H+] • [HO-] так же постоянно. А поскольку при диссоциации молекулы воды образуется одинаковое количество ионов [H+] и [HO-], получается что для чистой воды концентрации [H+] и [HO-] будут равны 10-7 моль/л. Из постоянства ионного произведения воды следует, что если количество ионов H+ становится больше, то количество ионов HO- становится меньше. Например, если к чистой воде добавить сильную кислоту HCl, она как сильный электролит вся продиссоциирует на H+ и Cl-, в результате концентрация ионов H+ резко увеличится, и это приведет к увеличению скорости процесса противоположного диссоциации, так как она зависит от концентраций ионов H+ и OH-: υ2 = κ2 • [H+] • [HO-]
В ходе ускорившегося процесса противоположного диссоциации, концентрация ионов HO- уменьшится до величины соответствующей новому равновесию, при котором их будет так мало, что скорости диссоциации воды и обратного процесса снова будут равны. Если концентрация получившегося раствора HCl равна 0,1моль/л, равновесная концентрация [HO-] будет равна: [HO-] = 10-14/0,1 = 10-13 моль/л
Ионное произведение воды ́ - произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водныхрастворах, константа автопротолиза воды.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует: 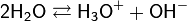
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
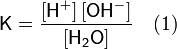
где:
· [H+] — концентрация ионов гидроксония (протонов);
· [OH−] — концентрация гидроксид-ионов;
· [H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как:
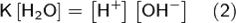
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот. Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+]. Хотя в большинстве случаев для удобства представления пользуются не абсолютными значениями концентраций, а взятыми с обратными знаком их десятичными логарифмами — соответственно, водородным показателем (pH) и гидроксильным показателем (pOH).
Так как Kв — константа, при добавлении к раствору кислоты (ионов H+), концентрация гидроксид-ионов OH− будет падать и наоборот. В нейтральной среде [H+] = [OH−] = 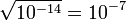 моль/л. При концентрации [H+] > 10−7 моль/л (соответственно, концентрации [OH−] < 10−7 моль/л) среда будет кислой; При концентрации [OH−] > 10−7 моль/л (соответственно, концентрации [H+] < 10−7 моль/л) — щелочной.
моль/л. При концентрации [H+] > 10−7 моль/л (соответственно, концентрации [OH−] < 10−7 моль/л) среда будет кислой; При концентрации [OH−] > 10−7 моль/л (соответственно, концентрации [H+] < 10−7 моль/л) — щелочной.
27. Буферные растворы: их состав, свойства, механизм действия. Буферная емкость
Буферные растворы — это растворы, содержащие буферные системы. Буферными системами называются смеси, в составе которых содержатся в определенном количественном соотношении слабые кислоты и их соли с сильными основаниями или слабые основания и их соли с сильными кислотами. Такие растворы обладают устойчивой концентрацией ионов Н+ при разбавлении нейтральным растворителем (водой) и добавлении к ним определенного количества сильных кислот или оснований.
Буферные растворы находятся в водах мирового океана, почвенных растворах и живых организмах. Эти системы выполняют функции регуляторов, поддерживающих активную реакцию среды при определенном значении, необходимом для успешного протекания реакций обмена веществ. Буферные растворы классифицируются на кислотные и основные. Примером первых может быть ацетатная буферная система, вторых — аммонийная. Различают естественные и искусственные буферные растворы. Естественным буферным раствором является кровь, содержащая гидрокарбонатную, фосфатную, белковую, гемоглобиновую и кислотную буферные системы. Искусственным буферным раствором может быть ацетатный буфер, состоящий из СН3СООН.
Особенности внутреннего состава и механизма действия буферных систем рассмотрим на примере ацетатной буферной системы: ацетатная кислота/ацетат натрия. В водной среде компоненты буферной системы подвергаются электролитической диссоциации. Ацетат натрия как соль слабой кислоты и сильного основания целиком диссоциирует на ионы. Наличие анионов в такой буферной смеси зависит от концентрации в ней соли и степени ее диссоциации. Концентрация ионов Н+ в буферной системе прямо пропорциональна концентрации в ней кислоты и обратно пропорциональна содержанию в ней соли этой кислоты.
Таким образом, концентрация ионов Н+ в основном буфере прямо пропорциональна концентрации в нем соли и обратно пропорциональна концентрации основания.
примеру, необходимо приготовить ацетатный буфер с несколькими значениями pH. Вначале приготовляют 5М растворы ацетатной кислоты и ацетата натрия. Для приготовления первого раствора берут по 50 мл каждого из компонентов. Руководствуясь формулой, определяют концентрацию ионов Н+ в полученном растворе.
Для следующего буферного раствора берут 80 мл раствора кислоты и 20 мл раствора соли, приготовленных ранее. Существует ряд прописей различных буферных растворов, применяемых в химическом анализе и лабораторной практике.
Для буферных растворов характерны некоторое свойства. К таковым, в первую очередь, относится буферность – способность сохранять постоянство концентрации ионов Н+ при добавлении в буферный раствор определенного количества сильной кислоты или сильного основания. Например, если к ацетатному буферу добавить небольшое количество хлоридной кислоты, сдвига рН в кислую сторону не произойдет, так как хлоридная кислота вступит в реакцию обменного разложения с солью слабой кислоты. В результате реакции сильная кислота, способная сдвинуть рН в кислую сторону, заменяется слабой кислотой и нейтральной солью. Степень диссоциации раствора слабого электролита при увеличении его концентрации уменьшается, стремится к нулю, и сдвиг рН не происходит.
Буферная ёмкость раствора (от англ. buffer — амортизатор, англ. buff — смягчать толчки) — такое количество кислоты или основания, нужное для изменения pH буферного раствора ровно на 1.
Буферная смесь, буферный раствор, буферная система — сочетание веществ, система, поддерживающая постоянство pH.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 5236; Нарушение авторских прав?; Мы поможем в написании вашей работы!