
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гравиметрический анализ. Сущность и методы титриметрическогь анализа. Исходные и рабочие титрованные растворы
|
|
|
|
Гравиметрический анализ — важнейший метод количественного химического анализа, в котором взвешивание является не только начальной, но и конечной стадией определения. Гравиметрический анализ основан на законе сохранения массы веществ при химических превращениях. Измерительным прибором служат аналитические весы. Результаты анализа выражают обычно в процентах. Гравиметрический анализ сыграл большую роль при становлении закона постоянства состава химических соединений, закона кратных отношений, периодического закона и др., применяется при определении химического состава различных объектов (горных пород и минералов), при установлении качества сырья и готовой продукции и т. д.
Титриметрический анализ может быть основан на различных типах химических реакций:
· кислотно-основное титрование — реакции нейтрализации;
· окислительно-восстановительное титрование (перманганатометрия, иодометрия, хроматометрия) — окислительно-восстановительные реакции;
· осадительное титрование (аргентометрия) — реакции, протекающие с образованием малорастворимого соединения, при этом изменяются концентрации осаждаемых ионов в растворе;
· комплексонометрическое титрование — реакции, основанные на образовании прочных комплексных соединений ионов металлов с комплексоном (обычно ЭДТА), при этом изменяются концентрации ионов металлов в титруемом растворе.
Титрованными растворами называются растворы точно известной концентрации. Существует два способа приготовления титрованных растворов.
1. Берут на аналитических весах точную навеску соответствующего вещества, растворяют ее в мерной колбе и доводят объем раствора водой до метки. Зная массу растворенного вещества (g) и объем полученного раствора (V), нетрудно вычислить его титр. Он равен, очевидно:
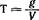
Титрованные растворы, полученные таким образом, называются растворами с приготовленным титром, или стандартными (точными) растворами. Их применяют в титриметрии как стандартные растворы для количественного определения тех или иных веществ и для установки титров других растворов. Понятно, что описанный способ приготовления титрованных растворов применим далеко не всегда. Его нельзя применять для приготовления титрованных растворов таких веществ, как HCl,
NaOH и т. д. Действительно, точная концентрация водных растворов HCl всегда неизвестна. Следовательно, даже взяв точную навеску этого раствора, нельзя рассчитать, сколько граммов хлористого водорода она содержит. То же относится и к NaOH, который жадно поглощает из воздуха CO2 и пары воды, причем его масса изменяется. Поэтому количество NaOH во взятой навеске также не будет точно известно.
Из этих примеров следует, что описанным выше способом можно готовить титрованные растворы только тех веществ, которые удовлетворяют требованиям, приведенным ниже.
Вещество должно быть химически чистым, т. е. не должно содержать посторонних примесей в таких количествах, которые могут повлиять на точность анализов (не более 0,05—0,1%).
Состав вещества должен строго соответствовать формуле. Например, кристаллогидраты должны содержать ровно столько воды, сколько соответствует их формулам.
Вещество должно быть устойчивым при хранении и в твердом виде, и в растворе, так как иначе легко нарушилось бы то соответствие состава формуле, о котором говорилось выше.
Желательна возможно большая величина грамм-эквивалента вещества, что позволяет увеличить точность установления нормальности раствора.
Удовлетворяющие указанным требованиям вещества называются исходными или стандартными, так как пользуясь ими, устанавливают титры всех остальных веществ.
2. Если вещество не удовлетворяет перечисленным выше требованиям, то сначала готовят раствор его приблизительно нужной нормальности. Параллельно с этим готовят титрованный раствор какого-нибудь подходящего исходного вещества. Далее один из растворов оттитровывают другим и, зная концентрацию раствора исходного вещества, вычисляют точную концентрацию приготовленного раствора.
Титрованные растворы, концентрацию которых находят (как для NaOH) в результате титрования или весовым анализом раствора, называются стандартизированными растворами, растворами с установленным титром, иногда их называют «рабочими» растворами. Отсюда ясно, какое большое значение имеют в титриметрическом анализе исходные вещества. Чем лучше они отвечают перечисленным выше требованияем, тем точнее могут быть установлены
Концентрации «рабочих» растворов (т. е. титрованных растворов, применяемых при определениях) и тем меньше будет погрешность этих определений. Концентрацию рабочих растворов не всегда устанавливают по исходным веществам. Например, установить концентрацию раствора NaOH можно также путем титрования его раствором HCl, концентрация которого установлена по соответствующему исходному веществу. Такой метод удобен в том отношении, что при нем уменьшается число исходных веществ и, следовательно, экономится время, затрачиваемое на их очистку. Однако он менее точен, так как погрешности, допускаемые при установке отдельных концентраций, при этом суммируются.
Иногда концентрацию устанавливают путем гравиметрического анализа раствора. Например, концентрацию раствора HCl можно установить по массе осадка AgCl, полученного при действии на определенный объем раствора HCl раствором AgNO3. Точно так же для установления концентрации раствора H2SO4 можно подействовать на определенный его объем раствором BaCl2 и взвесить полученный осадок BaSO4 и т. д.
При анализе природных соединений или продуктов производства вместо исходных веществ для установки концентрации титрованных растворов чаще пользуются так называемыми стандартными образцами. Стандартные образцы представляют собой образцы того материала, который будут анализировать при помощи данного титрованного раствора, но с точно известным содержанием определяемого элемента. Например, при определении марганца в сталях концентрацию употребляемого при этом раствора арсенита натрия Na3AsO3 устанавливают по навеске стандартного образца стали с точно известным содержанием марганца. При определении концентрации раствора тиосульфата натрия Na2S2O3, предназначаемого для определения меди в бронзах, употребляют стандартный образец бронзы с точно известным содержанием меди и т. д.
Титрование как при определении концентраций рабочих растворов, так и при выполнении анализов можно проводить двумя различными способами.
1. Навеску исходного (или анализируемого) вещества растворяют в мерной колбе, разбавляют водой до метки и тщательно перемешивают раствор, многократно перевертывая закрытую пробкой мерную колбу. Пипеткой отбирают отдельные порции раствора, содержащие какую-то определенную или, как говорят, аликвотнию часть навески, и титруют их. Такой способ работы называется методом пипетирования.
2. Берут отдельные, близкие по величине навески исходного (или анализируемого) вещества, и, растворив каждую из них в произвольном объеме воды, целиком титруют получаемые при этом растворы. Такой способ работы называется методом отдельных навесок.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1201; Нарушение авторских прав?; Мы поможем в написании вашей работы!