
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексообразование в аналитической химии. Диссоциация комплексных ионов. Константа нестойкости
|
|
|
|
Комплексные соединения. Координационная теория А.Вагнера. классификация и номенклатура комплексных соединений
Комплексные соединения — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемомукомплексообразователем, нейтральных молекул или других ионов, называемыхлигандами.
Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей).
Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+), либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.
Теория координационных соединений, предложенная А. Вернером в 1893 году, до сих пор является основной теорией координационных соединений (для комплексов определенного вида).
Ее основные положения.
1. Большинство элементов проявляет два типа валентности – главную и побочную.
2. Атом элемента стремится насытить не только главные, но и побочные валентности.
3. Побочные валентности атома строго фиксированы в пространстве и определяют геометрию комплекса и его различные свойства.
В соответствии с изложенными представлениями Вернера строение первого из указанных в таблице 1 комплексов выглядело так, как показано ниже. Для остальных соединений стехиометрическое соотношение исходных веществ таково, что молекул аммиака не хватает для насыщения всех шести побочных валентностей и их насыщают ионы хлора. При этом хлор, насыщающий эти валентности меняет свое состояние и уже не может обмениваться в реакциях ионного обмена. Те же ионы хлора, которые насыщают только главные валентности имеют те же свойства, что и в исходном хлориде кобальта и, как и в последнем, могут замещаться или обеспечивать электропроводность комплекса.
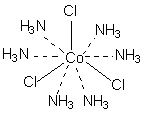
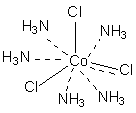
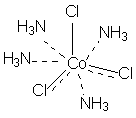
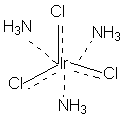
В последнем соединении все три хлора участвуют не только в насыщении главной, но и побочных валентностей. В связи с этим в нем нет «подвижных» ионов хлора и он не способен на ионные реакции и не проводит электрический ток.
Главная валентность обусловлена, как уже упоминалось, степенью окисления кобальта (+3), то есть электростатическим притяжением трех однозарядных ионов хлора и одного трехзарядного иона кобальта. Побочная же валентность обусловлена так называемым явлением координации, которое, с современных позиций, может иметь различную природу. Те ионы, атомы, молекулы, которые координируются ионом металла называют лигандами; вместе с ионом металла они образуют так называемую внутреннюю координационную сферу. Не трудно заметить, что, несмотря на различие в строении комплексов, количество лигандов в каждом случае равно шести, однако в первом из соединений ни один из ионов хлора не является лигандом, так как не входит во внутреннюю координационную сферу, а образует так называемую внешнюю сферу противоионов, которая для последнего из соединений в ряду полностью отсутствует.
Ионы, не входящие во внутреннюю координационную сферу, при растворении комплекса обуславливают его электропроводность. В соответствии с этим диссоциацию комплексов можно записать так:
[Co(NH3)6]Cl3 ↔ [Co(NH3)6]3+ + 3Cl-
[Co(NH3)5Cl]Cl2 ↔ [Co(NH3)5Cl]2+ + 2Cl-
[Co(NH3)4Cl2]Cl ↔ [Co(NH3)4Cl2]+ + Cl-
[Ir(NH3)3Cl3] – не диссоциирует
Таким образом, первые два тезиса теории Вернера закрывают вопросы 1 – 3. Остановимся подробнее на третьем тезисе теории Вернера, а именно на том, что побочные валентности фиксированы в пространстве и определяют геометрию комплекса и его стереохимию.
Значительное разнообразие КС затрудняет их классификацию.
Наиболее распространена классификация по типу лигандов.
1. Аквакомплексы в качестве лигандов содержат молекулы воды - H2O. Образуются они при взаимодействии безводных веществ с водой (в частности, при растворении в воде), например:
CuSO4(т) + 4H2O = [Cu(H2O)4]SO4(р)
CuSO4 + 4H2O = [Cu(H2O)4]2+ + SO42-
NiSO4(т) + 6H2O = [Ni(H2O)6]SO4(р)
NiSO4 + 6H2O = [Ni(H2O)6]2+ + SO42-
2. Гидроксокомплексы в качестве лигандов содержат гидроксид-ионы - OH-. Образуются при взаимодействии металлов, оксиды и гидроксиды которых амфотерны, а также указанных оксидов и гидроксидов с избытком раствора щелочи, например:
Zn(т) + 2H2O(р) = Zn(OH)2(т) + H2(г) - 1 стадия
Zn(OH)2(т) + 2NaOH(р) = Na2[Zn(OH)4] (р) - 2 стадия
Сложив два уравнения, получим итоговое уравнение реакции:
Zn(т) + 2H2O(р) + 2NaOH(р) = Na2[Zn(OH)4] (р) + H2(г)
Zn + 2H2O + 2OH- = [Zn(OH)4]2+ + H2
PbO(т) + H2O(р) + 2NaOH(р) = Na2[Pb(OH)4] (р)
PbO + H2O + 2OH- = [Pb(OH)4]2-
Sn(OH)2(т) + 2NaOH(р) = Na2[Sn(OH)4] (р)
Sn(OH)2 + 2OH- = [Sn(OH)4]2-
Кроме того, гидроксокомплексы получают обменной реакцией взаимодействия солей металлов, гидроксиды которых амфотерны, с избытком раствора щелочи, например:
BeSO4(р) + 4NaOH(р) = Na2[Be(OH)4] (р) + Na2SO4(р)
Be2+ + 4OH- = [Be(OH)4]2-
3. Амминокомплексы (аммиакаты, аммины) в качестве лигандов содержат молекулы аммиака - NH3. Образуются амминокомплексы как в водном растворе гидрата аммиака (при его избытке):
AgNO3(р) + 2(NH3× H2O) (р) = [Ag(NH3)2]NO3(р) + 2H2O
Ag+ + 2(NH3× H2O) = [Ag(NH3)2]+ + 2H2O
Co(OH)2(т) + 6(NH3× H2O) (р) = [Co(NH3)6](OH)2(р) + 6H2O
Co(OH)2 + 6(NH3× H2O) = [Co(NH3)6]2+ + 2OH- + 6H2O,
так и при действии на вещества (или при пропускании через раствор вещества) газообразного или жидкого аммиака, например:
Mg(ClO4)2(т) + 6NH3(г) = [Mg(NH3)6](ClO4)2(р)
Mg(ClO4)2 + 6NH3 = [Mg(NH3)6]2+ + 2ClO4
Cd(OH)2(т) + 6NH3(ж) = [Cd(NH3)4](OH)2(р)
Cd(OH)2 + 6NH3 = [Cd(NH3)4]2+ + 2OH-
4. Ацидокомплексы в качестве лигандов содержат анионы (кислотные остатки), их получают взаимодействием, чаще всего, двух солей:
HgCl2(р) + 4KI(р) = K2[HgI4] (р) + 2KCl(р)
Hg2+ + 4I- = [HgI4]2-,
а также взаимодействием металлов, оксидов с солями, кислотами, смесями кислот (царская водка и др.):
4Ag(т) + 8KCN(т) + 2H2O(ж) + O2(г) = 4K[Ag(CN)2] (р) + 4KOH(р)
SiO2(т) + 6HF(р) = H2[SiF6] (р) + 2H2O(р)
Au(т) + 4HCl(р) + HNO3(р) = H[AuCl4] (р) + NO(г) + 2H2O(р)
3Ti(т) + 4HNO3(р) + 18HF(р) = 3H2[TiF6] (р) + 4NO(г) + 8H2O(р)
5. Карбонилкомплексы (карбонилы) в качестве лигандов содержат молекулы монооксида углерода - CO. Карбонилкомплексы получают взаимодействием d- металлов в порошкообразном состоянии с газообразным CO при повышенном давлении и обычных температурах или небольшом (200-300 °С) нагревании, например:
Ni(т) + 4CO(г) [Ni(CO)4] (ж)
Fe(т) + 5CO(г) [Fe(CO)5] (ж)
Комплексообразование.
При описании равновесий комплексообразования следует помнить, что ионы в растворе всегда сольватированы. Поскольку в разбавленных растворах активность растворителя практически постоянна, а точное число молекул растворителя, сольватирующегоион, не всегда известно, то равновесия комплексообразования обычно представляют в следующем виде:
Практически все реакции комплексообразования в растворах представляют собой реакции замены лигандов в исходных, термодинамически менееустойчивых, комплексов (например, аквакомплексов) на другие лиганды собразованием более устойчивых продуктов.
1), комплексообразование можно трактовать как один из видов кислотно-основных равновесий, в котором роль кислоты играет акцептор электронов (центральный ион), а роль основания — донор электронов (лиганды).
В качестве важных характеристик кислот и оснований Льюиса, определяющих их взаимное сродство при реакциях комплексообразования, Пирсонввел понятия мягкости и жесткости.
Разумеется, приведенные рассуждения следует считать достаточно грубыми, поскольку, во-первых, высвобождающиеся в результате комплексообразования молекулы Н2О не остаются в свободном состоянии, а включаются в общую достаточно упорядоченную структуру воды, а во-вторых, продукт реакции (комплекс) также сольватируется.
Чтобы понять суть энталышйной составляющей хелатного эффекта, рассмотрим, из чего состоит величина ДЯ° — изменение стандартной энтальпии системы в результате комплексообразования. Вторая составляющая (ДЛ^) обусловлена изменениемэнергии лигандов в результате комплексообразования за счет стерическихфакторов (ориентация лигандов вокруг центрального атома и связанное с нейих взаимное отталкивание, деформация лигандов и т.
Таким образом, пяти- и шестичленный размер циклов являетсянаиболее благоприятным и с точки зрения энтропийной, и энталышйной составляющей комплексообразования. 3,3' также возникают стерические затруднения при комплексообразовании, но они имеют иной характер.
Изменение Е° при комплексообразовании можно использовать для стабилизации неустойчивых в водных растворах степеней окисления элементов.
Учитывая установленные закономерности комплексообразования и факторы, влияющие на свойства органических реагентов и их комплексов, можно синтезировать новый органический реагент с более выгодными свойствами для решения конкретной аналитической задачи.
Комплексообразование приводит к изменению электронной структуры хромофора и, следовательно, к изменению окраски реагента..
Функционально-аналитическая группировка(ФАГ) — это сочетание различных функциональных групп, содержащиходинаковые или разные по природе атомы, и пространственно расположенных для возможности замыкания цикла при комплексообразовании.
Иминодиацетатная группа образует бесцветные комплексы, а система сопряженных связей при комплексообразовании вызывает появление окраски как в исходном, так и в модифицированном реагентах. Хелаты образует енольная форма реагента, поэтому енолизация является необходимой предпосылкой для комплексообразования.
Для повышения эффективности разделения реакцию осаждения комбинируют с кислотно-основными, окислительно-восстановительными реакциями и реакциями комплексообразования. Таким образом, скорость экстракции в этих системах определяется в первую очередь скоростью комплексообразования, которая в свою очередь пропорциональна концентрации дитизона в водной фазе. Взаимодействие ионов с поверхностью ХМК, содержащих ионогенные и комплексообразующие группы, осуществляется главным образом по механизму ионного обмена и комплексообразования.
Комплексообразование для селективного разделения веществ в ГАХ используют редко.
Константа диссоциации характеризует термодинамическую устойчивость комплекса, зависящую от энергии связи между центральным атомом и лигандом. Различают также кинетическую устойчивость, или инертность, комплексной группировки — неспособность комплексного иона быстро обменивать внутрисферные ионы или молекулы на другие адденды. Например, [Fe (H2O)6]3+ и [Сr (H2O)6]3+ имеют почти одинаковые энергии связи Me — H2O (116 и 122 ккал/моль), но первый комплекс обменивает лиганды быстро, а второй (инертный) — медленно.
При растворении солей в различных органических и неорганических жидкостях образуются разнообразные сольватокомплексы. Кристаллические сольватокомплексы называют кристаллосольватами. К ним относятся продукты присоединения аммиака —Аммиакаты, например [Ni (NH3)6] Cl2, продукты присоединения спирта — алкоголяты, эфира — эфираты и т. д. Сложные молекулы присоединяются к центральному атому через атомы кислорода (вода, спирты, эфиры и т. п.), азота (аммиак, его органические производные — амины), фосфора (PCl3, производные фосфина), углерода и др. Часто лиганд присоединяется к центральному атому несколькими из своих атомов. Такие лиганды называют полидентатными. Среди сложных органических производных встречаются лиганды, координирующиеся двумя, тремя, четырьмя, пятью, шестью и даже восемью атомами (соответственно би-, три-, тетра-, пента-, гекса- и октадентатные лиганды). Полидентатные органические лиганды могут образовать циклические комплексы типа неэлектролитов (см. Внутрикомплексные соединения), например:
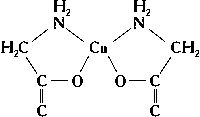
Самыми лучшими лигандами в смысле устойчивости образуемых ими К. с. являются Комплексоны — аминополикарбоновые кислоты, среди которых наибольшее распространение получила этилендиаминтетрауксусная кислота.(HOOCCH2)2NCH2CH2N (CH2COOH)2 (комплексон II, ЭДТА).
Неорганические ацидолиганды обычно моно-, реже бидентатны. Например, в соединении (NH4)2[Ce (NO3)6] каждая NO3-группа присоединяется к атому церия двумя атомами кислорода и является бидентатной. К. ч. Се в этом соединении равно 12.
Между К. с. и обычными (простыми) соединениями нет определённой границы. Одни и те же вещества, в зависимости от поставленных задач исследования, часто можно рассматривать и как простые и как комплексные. Например, в любом кристаллическом неорганическом веществе атомы, обычно относимые к комплексообразователям, обладают определённым К. ч. и, следовательно, ближайшей сферой, принципиально не отличимой от аналогичной группировки в обычном К. с.
Теория строения К. с. берёт своё начало от представлений А. Вернера (1893), который ввел важные для целого исторического периода понятия «главной» и «побочной» валентности, а также представления о координации, координационном числе, геометрии комплексной молекулы. Значительный вклад в исследование химии К. с., и, в частности, в установление связи между строением К. с. и реакционной способностью координированных групп, внесли советские учёные Л. А. Чугаев, И. И. Черняев и др.
Однако классическая координационная теория оказалась бессильной объяснить причины образования К. с. некоторых новых классов, предсказать их строение, а также установить взаимосвязь между строением и физическими свойствами К. с.
Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости. Для записи константы нестойкости К уравнение диссоциации составляется обычным способом (без участия молекул воды):
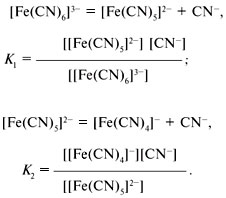
Общая константа нестойкости равна произведению ступенчатых констант нестойкости.
Константа устойчивости относится к процессу образования комплексного иона и равна обратной величине константы нестойкости: Куст = 1/Кнест.
Константа устойчивости характеризует равновесие образования комплекса.
Константы нестойкости или константы устойчивости определяются различными физико-химическими методами. Использование химических методов затруднено, т.к. измерение равновесных концентраций веществ часто приводит к смещению равновесия.
Например, если вы захотите определить константу нестойкости иона [Pt(NH3)4Cl2]2+, диссоциирующего по уравнению:
[Pt(NH3)4Cl2]2+ = [Pt(NH3)4Cl]3+ + Сl–,
измеряя равновесную концентрацию свободных хлорид-ионов в растворе осаждением их при приливании раствора нитрата серебра, то начнется диссоциация иона [Pt(NH3)4Cl]3+:
[Pt(NH3)4Cl]3+ = [Pt(NH3)4]4+ + Сl–.
Поэтому измеренное количество образовавшегося хлорида серебра не будет соответствовать количеству хлорид-ионов, образующихся при равновесии с ионом [Pt(NH3)4Cl]3+.
Концентрацию комплексных соединений в растворе можно определять методами, которые не нарушают равновесия. Наиболее часто пользуются спектрофотометрическим и электрометрическим методами.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 8801; Нарушение авторских прав?; Мы поможем в написании вашей работы!