
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поняття про ентропію (S)
|
|
|
|
Поняття про ентропію введене в науку Клаузіусом в 1850 році. Стан системи характеризують безпосередньо параметрами вимірювання речовини: тиском, об'ємом, температурою. Ці величини характеризують усереднені властивості великого числа часток (молекул, атомів), тобто макростан речовини.
Якщо вказують миттєві характеристики кожної частки, тобто задають їх положення в просторі, напрямок і швидкість руху, то цим характеризують мікростан речовини.
Системи містять величезну кількість часток, які безперервно рухаються і змінюють свою швидкість і положення в просторі. Тому даному мікростану речовини відповідає велика кількість W різних мікростанів. Число мікростанів, за допомогою яких даний мікростан речовини може визначатися, називається термодинамічною імовірністю його стану (W). Система, для якої можливий перехід з одного стану в інший, прагне перейти в менш впорядкований - більш вірогідний стан. Мірою безладдя або мірою імовірності стану речовини або системи є ентропія. Зв'язок між цими величинами виражається формулою Больцмана:
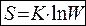 , де
, де 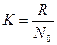 - константа Больцмана;
- константа Больцмана;
R - універсальна газова стала (R = 8,314 Дж.моль-1К-1);
N0 - число Авогадро (6,023.1026 атомів/кмоль або 6,023.1023 атомів/ моль.
Ентропія речовини (при певних Т, V, Р) пропорційна логарифму термодинамічної імовірності W стану речовини.
Ентропію виражають в Дж/К (Джоуль на Кельвін) і відносять до одного молю речовини, тобто Дж/К.моль або Дж.К-1.моль-1. Таким чином, одиниця вимірювання ентропії співпадає з одиницею вимірювання універсальної газової сталої, тобто:
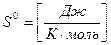 . Тут S0 - є стандартна ентропія, значення якої при 298К (250С) називається абсолютною ентропією, тобто S0298. Значення абсолютних ентропій можуть бути визначеним (обчислені) і приводяться в таблицях.
. Тут S0 - є стандартна ентропія, значення якої при 298К (250С) називається абсолютною ентропією, тобто S0298. Значення абсолютних ентропій можуть бути визначеним (обчислені) і приводяться в таблицях.
Ентропія є функцією, яка визначає можливість перебігу самочинного процесу в ізольованій системі. Саме на цій термодинамічній функції ґрунтується другій закон термодинаміки: в ізольованих системах самочинно відбуваються процеси в напрямку збільшення ентропії, і стану термодинамічної рівноваги відповідає її максимальне значення.
Ентропія збільшується в процесах плавлення, випаровування, розчинення твердої речовини в рідині, по мірі ускладнення складу речовини або підвищення його маси. Наприклад, в процесах перетворення атомарного кисню в молекулярний і потім озон, ентропія відповідно зростає, тобто:
О ® О2 ® О3
S0: 61 205 238 Дж/К.моль.
Зміну ентропії DS в хімічних реакціях можна обчислити:
DS0 = åіS(кін) - åіS(поч.) (14).
Приклад. Обчислити зміну ентропії для реакції та зробити висновок про можливість її самочинного перебігу:
С(т)діамант + Н2О(п) = СО2(г) + Н2(г)
S0: 2,44 188,72 197,91 130,59 Дж/К.моль
DS0х.р. = (S0СО + S0Н2) - (S0C + S0Н2O) або
DS0х.р. = (197,91 + 130,59) - (2,44 + 188,72) = 137,34 Дж/К.моль.
Отже, DS0х.р.> 0, реакція може відбуватися самочинно в прямому напрямку.
Третій закон термодинаміки. У 1912 році Планк запропонував постулат: при наближенні до абсолютного нуля ентропія So чистої кристалічної речовини без дефектів у кристалічній решітці прямує до нуля: lim S = 0, T → 0. Цей постулат одержав назву третього закону термодинаміки. Він стверджує, що при наближенні до абсолютного нуля досягається повна впорядкованість, і макростан кристала чистої речовини може бути реалізований лише одним способом.
Третій закон термодинаміки дає змогу визначити абсолютну ентропію SТ усіх чистих речовин при певній температурі, яка чисельно дорівнює зміні ентропії при рівноважному переході 1 моль кристалічної речовини від абсолютного нуля до даної температури:
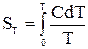 , (15)
, (15)
де С – молярна теплоємність речовини.
За стандартних умов (Т = 298К і р=101,3 кПа) абсолютну ентропію називають стандартною і позначають S°298. Якщо відома стандартна ентропія, можна обчислити значення абсолютної ентропії даної речовини за будь-якої температури:
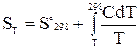 . (16)
. (16)
Для закритих систем аналогічними функціями є термодинамічні потенціали: енергія Гельмгольца F (ізохорно-ізотермічний потенціал) і енергія Гіббса G (ізобарно-ізотермічний потенціал). В хімії енергія Гіббса має більш поширене використання, ніж енергія Гельмгольца, тому що хімічні процеси відбуваються частіше при сталомому тиску, а не при сталому об’ємі.
Енергія Гельмгольца і енергія Гіббса виражаються рівняннями:
F = U–TS; (17)
G = H–TS. (18)
Ці два термодинамічні потенціали є функціями стану. Вони залежать від природи речовин (що приймають участь у реакції), їх маси і температури. Абсолютні значення термодинамічних потенціалів невідомі, а для розрахунків використовують зміни потенціалів (∆F і ∆G, кДж/моль).
Третій закон термодинаміки також стверджує, що при наближенні системи до абсолютного нуля, криві ∆G та ∆Н співпадають і мають спільну дотичну, яка паралельна вісі абсцис.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1472; Нарушение авторских прав?; Мы поможем в написании вашей работы!