
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок і молекулярність хімічних реакцій
|
|
|
|
Вплив температури на швидкість хімічної реакції.
Навіть незначна зміна температури може помітно змінити швидкість хімічної реакції. Вант-Гофф встановив, що зі збільшенням температури на кожні 10 градусів швидкість більшості гомогенних реакцій збільшується в 2-4 рази. Збільшення швидкості реакції при підвищенні температури пов'язано зі зростанням константи швидкості реакції, тому що концентрації реагуючих речовин при цьому практично не змінюються. Показник, який вказує, у скільки разів підвищується константа швидкості реакції при збільшенні температури на 10 градусів, називається температурним коефіцієнтом (g). Математично це правило можна виразити співвідношенням:
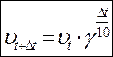 .
.
На підставі цього виразу можна записати:
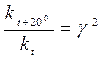 ;
;  і
і 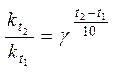
або  (2).
(2).
Хімічні реакції класифікують за молекулярністю і порядком. Молекулярністьреакції визначається числом молекул, що беруть участь в елементарному акті хімічної взаємодії.
Відомі моно-, би-, і тримолекулярні реакції. До мономолекулярних відносяться реакції розкладення, наприклад:
I2 = I + I,
N2O4 = 2 NO2,
а також процеси, які пов'язані з внутрішньо молекулярними перегрупуваннями (ізомеризація).
У елементарному акті бімолекулярних реакцій приймають участь дві молекули одного або різних речовин:
НI + НI = I2 + Н2, CO + CI2 = COCL2,
тримолекулярних - три молекули:
2 NO + O2 = 2 NO2.
Останні зустрічаються досить рідко. Одночасне зіткнення більш ніж трьох молекул малоймовірно. Реакції, у рівняння яких входить велике число молекул, наприклад: 4 HCl + O2 = 2 Cl2 + 2 H2O, протікають у декілька стадій, кожна з який є моно-, би- (рідше три-) молекулярною. У цьому випадку закон діючих мас застосовується до окремих стадій процесу, але не до реакції в цілому. Загальна швидкість таких багатостадійних реакцій визначається швидкістю протікання найбільше повільної зі стадій. Внаслідок багатостадійності більшості хімічних процесів вирішення питання про молекулярність є ускладненим. Тому для кінетичної характеристики таких експериментальних реакцій використовують більш формальне поняття - порядок реакції.
Порядок реакції визначається сумою показників ступеня (m + n + …), у який зводяться концентрації реагуючих речовин, які входять до виразу закону діючих мас. (I)
За порядком реакції бувають: першого, другого, третього і дробного порядків, а також нульового порядку, якщо швидкість процесу не залежить від концентрації реагуючих речовин. Порядок реакції визначають дослідним шляхом.
Для простих за механізмом реакцій поняття молекулярності і порядку співпадає, але дуже часто порядок реакції не відповідає її молекулярності. Це пояснюється тим, що більшість хімічних процесів є сукупністю послідовних або паралельних елементарних реакцій. У ряді випадків розбіжність молекулярності і порядку реакції обумовлено великим надлишком одного з реагентів. Так, при інверсії сахарози (С12Н22О11) у розведеному водному розчині HCl:
Н+
С12Н22О11 + Н2О Û С6Н12О6 + С6Н12О6
Глюкоза фруктоза
зміна концентрації води настільки незначна, що нею можна зневажити. Тоді в кінетичному рівнянні швидкості цієї реакції залишиться лише концентрація сахарози: u = k [C12H22O11].
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 3747; Нарушение авторских прав?; Мы поможем в написании вашей работы!