
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типові задачі
|
|
|
|
Зсув рівноваги.
Стан хімічної рівноваги в даних умовах може зберігатися тривалий час. При зміні хоча б одного з зовнішніх умов (температури, тиску, концентрації) рівновага порушується, тому що при цьому швидкості протилежних процесів змінюються в різному ступені. Напрямок зсуву хімічної рівноваги визначається принципом Ле-Шателье: При зміні зовнішніх умов у рівноважній системі відбудеться зсув рівноваги убік тієї реакції, що протидіє зміні.
§ Вплив температури. Підвищення температури призведе до зсуву рівноваги в напрямку ендотермічної реакції, зниження – в напрямку екзотермічної реакції. У реакціях, які відбуваються без теплових ефектів, (наприклад, етерифікації) зміна температури не впливає на рівновагу.
§ Вплив тиску. Збільшення тиску зміщає рівновагу газових реакцій убік процесів, що протікають з утворенням меншого числа молекул газу, зменшення - убік утворення більшого числа молекул. У процесах, що не супроводжуються зміною об¢єму, тиск практично не впливає на зсув рівноваги.
§ Вплив концентрації. Збільшення концентрації вихідних речовин або зменшення концентрації кінцевих продуктів (видалення їх із сфери реакції) сприяє протіканню прямої реакції і навпаки.
Задача 1. У системі СО + Сl2 = COCl2 концентрацію СО збільшили від 0,3 до 1,2 моль/ л, а концентрації хлору - від 0,2 до 0,6 моль/ л. У скільки разів зросла швидкість прямої реакції?
Рішення:
Відповідно до закону діючих мас (1) швидкість даної реакції (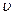 ) можна представити через концентрації реагуючих речовин:
) можна представити через концентрації реагуючих речовин: 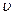 = k [СО]×[Сl2],
= k [СО]×[Сl2],
де [CO] - концентрація оксиду вуглецю, [Сl2]-концентрація хлору, k-коефіцієнт пропорційності (константа швидкості).
Початкова швидкість 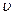 1= k1×0,3×0,2 = 0,06 k1. Зі збільшенням концентрації реагуючих речовин вона зростає і складе
1= k1×0,3×0,2 = 0,06 k1. Зі збільшенням концентрації реагуючих речовин вона зростає і складе 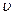 2 = k2 . 1,2 . 0,6 = 0,72 k2.
2 = k2 . 1,2 . 0,6 = 0,72 k2.
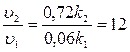 , тобто швидкість прямої реакції зросте у 12 разів.
, тобто швидкість прямої реакції зросте у 12 разів.
Задача 2. Як зміниться швидкість реакції 2 NO(Г) + O2(Г) = 2 NO2(Г), якщо:
а) збільшити тиск у системі в 3 рази; б) підвищити концентрацію NO у 3 рази?
Рішення:
а) До зміни тиску швидкість реакції можна представити рівнянням:
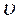 = k [NO]2×[O2]. Внаслідок збільшення тиску в 3 рази концентрація кожної з реагуючих речовин також зросла в 3 рази. Швидкість змінилася і склала:
= k [NO]2×[O2]. Внаслідок збільшення тиску в 3 рази концентрація кожної з реагуючих речовин також зросла в 3 рази. Швидкість змінилася і склала:
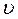 ¢ = k(3[NO]2 × 3[O2]). = 27 k [NO]2×[O2].
¢ = k(3[NO]2 × 3[O2]). = 27 k [NO]2×[O2].
Порівнюючи вирази швидкостей 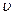 і
і 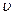 ¢, знаходимо, що швидкість реакції зросла в 27 разів.
¢, знаходимо, що швидкість реакції зросла в 27 разів.
б) С підвищенням концентрації NO у 3 рази швидкість буде дорівнювати:
 ¢¢= k (3[NО])2×[O2] = 9 k[NO]2×[O2].
¢¢= k (3[NО])2×[O2] = 9 k[NO]2×[O2].
Порівнюючи вирази швидкостей 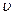 і
і 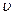 ¢¢, знаходимо, що швидкість реакції зросте у 9 разів.
¢¢, знаходимо, що швидкість реакції зросте у 9 разів.
Задача 3. Реакція між речовинами А і В відбувається за рівнянням:
А + 2В = С. Вихідні концентрації складають: [А]0= 0,3 моль/ л,
[В]0= 0,5 моль/ л. Константа швидкості реакції дорівнює 0,4. Знайти початкову швидкість реакції і швидкість реакції після закінчення деякого часу, коли концентрація речовини А зменшиться на 0,1 моль/ л.
Рішення:
Відповідно до закону діючих мас швидкість реакції в початковий момент складає:
 0= k [А]0×[В]02 = 0,4×0,3×0,52 = 0,4×0,3×0,25 = 0,03.
0= k [А]0×[В]02 = 0,4×0,3×0,52 = 0,4×0,3×0,25 = 0,03.
Після закінчення деякого часу концентрація речовини А зменшиться на 0,1 моль/ л і буде дорівнювати [A]1 = 0,3-0,1=0,2 моль/ л. За цей ж час прореагує удвічі більше речовини В (за рівнянням реакції 1 моль речовини А реагує з 2 моль речовини В) і концентрація її складе [В]1= 0,5-0,2 = 0, 3 моль/ л.
Швидкість реакції в цей момент:
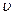 1= k [А]1×[В]12 = 0,4×0,2×0,32 = 0,08×0,09 = 0,0072.
1= k [А]1×[В]12 = 0,4×0,2×0,32 = 0,08×0,09 = 0,0072.
Задача 4. В скільки разів збільшиться швидкість реакції, якщо підвищити температуру на 300 при g=3?
Рішення:
Відповідно до правила Вант-Гоффа (2):
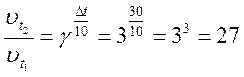 , тобто швидкість реакції збільшиться в 27 разів.
, тобто швидкість реакції збільшиться в 27 разів.
Задача 5. Чому дорівнює температурний коефіцієнт швидкості реакції, якщо при збільшенні температури на 500 швидкість реакції зростає в 32 рази?
Рішення:
Відповідно до рівняння Вант-Гоффа (2):
 ; 32 = 25;
; 32 = 25;
g5 = 25; g = 2.
ПИТАННЯ ДЛЯ САМОСТІЙНОГО КОНТРОЛЮ:
1. Що розуміють під швидкістю хімічних реакцій? Розкрийте фізичний зміст константи швидкості реакції. Які фактори на неї впливають?
2. Вплив концентрації на швидкість реакції. Закон діючих мас.
3. Вплив температури на швидкість реакції. Енергія активації, розрахунок енергії активації.
4. Вплив каталізаторів на швидкість реакцій. Поняття гомогенного та гетерогенного каталізу. Автокаталіз. Ферментативний каталіз.
5. Кінетика гетерогенних реакцій.
6. Оборотні та необоротні хімічні реакції. Хімічна рівновага.
7. Вплив зміни концентрації реагуючих речовин на стан хімічної рівноваги.
8. Вплив температури на стан хімічної рівноваги. Закон Вант-Гоффа.
9. Принцип Ле Шателье
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1813; Нарушение авторских прав?; Мы поможем в написании вашей работы!