
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекція ІX. Агрегатні стани речовини. Будова твердого тіла
|
|
|
|
План:
1. Загальна характеристика агрегатних станів.
2. Газоподібний стан. Закони ідеальних газів.
3. Кристалічний стан речовини. Типи кристалічних граток.
4. Реальні кристали.
5. Аморфний стан речовини.
6. Рідкий стан речовини.
Майже кожна речовина може знаходитись в одному з агрегатних станів: твердому, рідкому, газоподібному та плазмовому. Агрегатний стан речовини є функцією температури і тиску. Однак, це не означає, що, змінюючи температуру і тиск, для будь-якої речовини можна реалізувати декілька агрегатних станів: газ, рідина, тверда речовина. Білкові речовини не можуть перебувати у газоподібному стані, бо при нагріванні вони деструктивно розкладаються. Цілий ряд неорганічних сполук мають аналогічні властивості. Але таки речовини, як, наприклад, вода, при певній температурі і тиску можуть одночасно перебувати в трьох агрегатних станах.
Основна риса газоподібного стану – мала густина речовини, значна відстань між молекулами, малі сили притягання, внаслідок чого газ прагне зайняти максимальний об’єм і оскільки, міжмолекулярні відстані в газах великі, на відміну від твердих тіл і рідин, газоподібні речовини здатні стискатися.
Відстані між молекулами в рідині значно менше, чим у твердих тілах. Сили притягання між молекулами більше. Рідини легко змінюють свою форму, наприклад, при переливанні з однієї посудини в іншу. При зниженні температури рідина набуває більш упорядкованої структури, тобто наближається до структури твердого тіла.
У твердих тілах відстань між молекулами мінімальна і сила притягання між ними дуже велика. Тому тверде тіло зберігає свою форму та об’єм. Молекули, атоми чи іони, з яких складаються тверді тіла, розміщені в певному порядку, тобто утворюють умовну структуру, яка називається кристалічною граткою.
За певних умов речовина може перебувати в четвертому агрегатному стані – стані плазми (це суміш атомів, позитивно заряджених іонів і атомних ядер, які безперервно рухаються). Утворюється цей стан при нагріванні газу до високих температур, внаслідок дії електричного чи магнітного поля і т. ін.. Прикладом природних об’єктів які представляють собою плазмовий стан є Сонце, зірки, блискавки.
Газоподібний стан. Газоподібний стан поділяють на: ідеальні та реальні гази. Дослідним шляхом було встановлено, що при низькій густині всі звичайні реальні гази ведуть себе приблизно однаково. Кількісно стан будь-якої маси таких газів описується законами ідеальних газів. Ідеальний газ – це газ, який характеризується значним ступенем розрідження. За таких умов силами міжмолекулярної взаємодії можна знехтувати. При цьому можна знехтувати і об’ємом молекул, оскільки він надзвичайно малий порівняно з об’ємом, який займає газ. Фізичний стан ідеального газу визначається трьома параметрами: температурою Т, тиском p і об’ємом V. Усі ці величини пов’язані між собою; залежність між ними називають рівнянням стану. Воно випливає з трьох газових законів: Бойля-Маріотта, Гей-Люссака і Шарля.
- Закон Бойля-Маріотта (описує залежність об’єму V даної маси газу від тиску p): об’єм даної маси ідеального газу при сталій температурі обернено пропорційний тиску
p1V1 = p2V2 = К, (1)
де К – стала величина.
Тобто, добуток об’єму газу на тиск при певній температурі є величиною сталою.
- Закон Гей-Люссака (описує залежність об’єму V газу від температури Т): об’єм даної маси ідеального газу при сталому тиску прямо пропорційний температурі.
V = KТ, (2)
де: V – об’єм газу; Т – абсолютна температура (за шкалою Кельвіна, 1 К = 273ºС); К – константа.
Ця залежність спостерігається і для нормальних умов (н.у.):
Vо = KТо. (2.1)
Нормальними називають умови, коли температура дорівнює 273К (0ºС), тиск становить 101325 Па (1 атм, або 760 мм рт. ст.).
За цих умов, як випливає з закону Авогадро: 1 моль будь-якого газу займає об’єм 22,4 л. Кількість молекул, яка міститься в 1 моль є величиною сталою:
NА = 6,02.1023 – число Авогадро.
- Закон Шарля (описує залежність тиску Р газу від температури Т): об’єм даної маси ідеального газу при сталому об¢ємі прямо пропорційний абсолютній температурі.
Р = KТ, (3), або 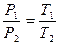
де: Р – тиск газу; Т – абсолютна температура; K – константа.
Кожен з цих законів описує властивості будь-якої маси ідеального газу при ізобарному, ізохорному або ізотермічному процесі. Кількісна залежність між всіма параметрами стану (Т, Р, V) для будь-якої маси ідеального газу, називається рівнянням стану ідеального газу:
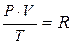 , або РV = RТ (4),
, або РV = RТ (4),
де R – універсальна газова стала (в міжнародній системі одиниць (СІ) R = 8,314·103 Дж/моль·K).
В такому вигляді рівняння було запропоноване Клапейроном для 1 моль газу. Для використання цього рівняння для деякої кількості моль газу Д.І. Менделєєвим було введено величину n, рівняння отримало вигляд:
РV =nRТ. (5)
В наш час це рівняння називають рівнянням Клапейрона-Менделеєва. Враховуючи величину 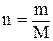 рівняння Клапейрона-Менделєєва можна записати:
рівняння Клапейрона-Менделєєва можна записати:
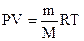 . (6)
. (6)
Цим рівнянням користуються, розраховуючи різні параметри: об’єм V, температуру Т, масу m, молярну масу М газа.
Реальні гази це такі, які існують у природі і перебувають в умовах порівняно високого тиску і низьких температур. Для характеристики їх стану необхідно враховувати сили міжмолекулярної взаємодії, об’єм самих молекул та міжмолекулярні відстані. Закони ідеальних газів для реальних газів не виконуються. Так, для азоту при Р = 1 атм добуток РV = 1000, а при Р = 430,86 атм РV =126,96 (відповідно з законом Бойля-Маріотта, РV є величиною незмінною, тобто, як би сильно не змінювали тиск, добуток РV не повинен змінюватись). Тому для реальних газів було запропоновано рівняння Ван-дер-Ваальса:
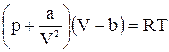 , (7)
, (7)
де: b – поправка на об’єм молекул (вона приблизно на 2,5% більша за об’єм одного моль даної речовини у рідкому стані); 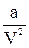 – величина міжмолекулярної взаємодії.
– величина міжмолекулярної взаємодії.
Це рівняння є емпіричним, тобто, параметри, що отримані за розрахунками на основі рівняння, не завжди співпадають з експериментально визначеними. Але, це рівняння задовільним чином описує стан реальних газів при переході їх в рідкий стан. Якщо збільшувати тиск і знижувати температуру, то майже всі гази можна перетворити в рідину. Однак на таку просту схему накладаються умови, суть яких в тому, що для кожного газу є гранична температура, вище якої газ не зможе бути переведений в рідину навіть при дуже високому тиску. Це так звана критична температура.Для зрідження газів необхідна температура нижче критичної, і чим нижча, тим менший вимагається тиск. Критичній температурі відповідає критичний тиск і критичний об’єм. Стан газу, що перебуває під критичним тиском при критичній температурі і займає критичний об’єм, називають критичним станом. Для ряду газів розраховані критичні константи (Таблиця 1).
Таблиця 1. Критичні константи деяких речовин.
| Речовина | Критична температура, С | Критичний тиск, ×105 Па | Критичний об’єм, л |
| Н2 | –239,9 | 12,966 | 0,064 |
| N2 | –147,0 | 83,935 | 0,090 |
| O2 | –118,8 | 50,346 | 0,078 |
| CO2 | +31,3 | 73,847 | 0,096 |
| H2O | +374,2 | 221,036 | 0,056 |
Рідкий стан. Рідина характеризується наявністю відповідно об’єму і відсутністю форми. Сили міжмолекулярного притягання не дають молекулам рідини віддалятися одна від одної на великі відстані і кожна молекула перебуває у сфері дії сусідніх молекул. Тому рідини характеризуються сталістю об’єму. Хоч сили міжмолекулярної взаємодії і великі, та все-таки недостатні, щоб утримувати молекули в певних точках простору. Тому рідина не має сталої форми, а набуває форми тієї посудини, в якій перебуває. Молекули рідини намагаються зайняти деяке впорядковане розташування в просторі; рідина має об’ємну пружність, як і тверді тіла, бо пружно протидіють не лише всебічному стисканню, а й всебічному розтягненню.
Властивості рідини залежать також від об’єму молекул, форми та їх полярності. Рідини, які містять полярні молекули, відрізняються властивостями від неполярних. Полярні молекули орієнтуються різнойменними кінцями диполів одна відносно одної; при цьому між ними виникають сили електростатичного притягання. Відбувається асоціювання двох чи більше молекул у комплекс. Асоціювання може бути спричинено, зокрема, утворенням водневих зв’язків між молекулами рідини. Властивості рідин залежать від ступеня асоціації, оскільки для розриву міжмолекулярних зв’язків потрібна значна енергія. Тому асоційовані рідини (вода, спирт та ін.), мають високу температуру кипіння, меншу леткість тощо. Так, кількісний і якісний склад етанолу і диметилового етеру однаковий (С2Н6О), але спирт – полярна речовина і належить до асоціатів і кипить при вищій температурі, ніж етер (неполярна речовина), який належить до неасоційованих рідин.
Важливою фізико-хімічною властивістю рідини є поверхневий натяг. Властивості молекул в поверхневому шарі рідини за фізико-хімічними властивостями відрізняються від властивостей молекул всередині кожного шару. Кожна молекула всередині рідини притягує до себе інші навколишні молекули і одночасно з такою ж силою притягується рівномірно з усіх боків молекулами, що оточують її. Силове поле кожної молекули всередині рідини симетрично насичене. На молекули, які знаходяться поблизу поверхні, діють слабкі сили притягання з боку межі фаз. Положення таких молекул енергетично нескомпенсоване. При попаданні молекули рідини на межу фаз некомпенсованість молекулярної взаємодії зростає. Це зумовлено тим, що інтенсивність взаємодії між молекулами рідини значно вища, ніж взаємодія між молекулами рідини та газу. Енергетична некомпенсованість молекул та межі фаз призводять до втягування молекул, розташованих на поверхні, у глибину рідини. Внаслідок цього виникає сила, під дією якої поверхня рідини на межі рідина-газ зменшується до мінімальних розмірів, а молекули поверхні наближаються до молекул нижчих поверхневих шарів. При цьому відстань між молекулами поверхневого шару менша, ніж між молекулами внутрішніх шарів. Молекули, розташовані на поверхні, не повністю реалізують свою здатність до взаємодії і тому мають нескомпенсований надлишок енергії, який називають вільною поверхневою енергією G. Відношення надлишку вільної поверхневої енергії G до одиниці площі поділу фаз S називають поверхневим натягом:  , (8)
, (8)
де: G – поверхнева енергія; S – площа поділу фаз; σ – поверхневий натяг.
Для чистих рідин поверхневий натяг залежить від природи рідини і температури, а для розчинів – від природи розчинника, від природи і концентрації розчиненої речовини.
Розчинені речовини можуть знижувати або підвищувати поверхневий натяг. Ті речовини, що значно знижують поверхневий натяг даної рідини, називають поверхнево-активними (ПАР). Для води поверхнево-активними є спирти, мила, білки, жовчні кислоти, глікозиди. Додавання таких речовин до води покращує спінювання, тобто утворення великої кількості нових поверхневих плівок рідини, що пояснюється зниженням поверхневого натягу.
Речовини, які підвищують поверхневий натяг рідини, називають поверхнево-неактивними. Поверхневий натяг води підвищується при розчиненні неорганічних кислот, лугів, деяких солей.
Існує декілька методів визначення поверхневого натягу: за відривом краплі, за висотою підняття рідини в капілярі, найбільшого тиску бульбашок. Найчастіше використовується сталагмометричний метод, який базується на застосуванні приладу – сталагмометра (Рис. 1).
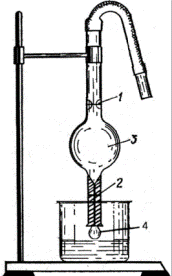 Рис. 1. Сталагмометр.
Рис. 1. Сталагмометр.
|
Прилад є капілярною трубкою з верхньою 1 і нижньою 2 мітками, а посередині – розширенням 3. Метод ґрунтується на тому, що крапля, яка утворюється на кінці капілярної трубки 4 сталагмометра, утримується силою поверхневого натягу. Крапля відривається у той момент, коли її вага дорівнює силі поверхневого натягу, що утримує краплю, або перевищить її на дуже незначну величину. Для рідини з більшим поверхневим натягом відрив крапель ускладнений, і утворювані краплі будуть більші, ніж у рідин з меншим поверхневим натягом, а тому кількість їх буде менша. Сталагмометр заповнюють рідиною і рахують число крапель n, що витікають з об’єму V. Потім прилад заповнюють дистильованою водою і рахують число крапель води n0, що витікає із цього самого об’єму V. Якщо з об’єму V витікає n крапель рідини, густина якої ρ, то вагу краплі визначають згідно з рівнянням:
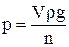 ,
,
де g – прискорення вільного падіння.
Сила поверхневого натягу, що утримує краплю, дорівнює 2πrσ, де 2πr – довжина кола отвору капіляра, від якого відривається крапля. В момент відриву краплі досліджуваної рідини справедливе рівняння:
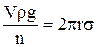 , (9)
, (9)
а для води:
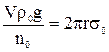 , (10)
, (10)
де: σо – поверхневий натяг води; ρо – густина води; nо – число крапель води. Якщо поділити рівняння (9) на (10), отримаємо залежність:
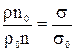 ,
,
з якої можна одержати формулу визначення поверхневого натягу:
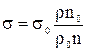 . (11)
. (11)
Для визначення вологості ґрунтів часто використовують метод капілярного підняття, який базується на вимірюванні висоти h рідини в капілярі. Поверхневий натяг вираховують за рівнянням:
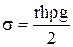 , (12)
, (12)
де: r – радіус капіляра; h – висота підняття рідини в капілярі; ρ – густина рідини; g – прискорення вільного падіння. Поверхневий натяг виражається в одиницях сили на одиницю довжини (н/м2), або величиною енергії на одиницю площі (Дж/м2).
Поверхневий натяг є одним із факторів, що визначає форму клітини і її частин. Локальним змінам поверхневого натягу належить важлива роль у процесах сприйняття і передачі нервових імпульсів, у фагоцитозі та проникності клітинних мембран.
Твердий стан речовини. Будь-яка речовина в твердому стані може мати кристалічну або аморфну будову. Кристалічні речовини мають певну внутрішню структуру, зумовлену правильним розміщенням частинок у чітко визначеному періодично повторюваному порядку. Розміри кристалів можуть бути різні: від дуже дрібних до гігантських. Характерні риси кристалічних тіл: строго визначена температура кипіння, явище анізотропії. Це пов’язано з тим, що у кристалах теплопровідність, швидкість росту кристалів, механічна міцність, швидкість розчинення та інші властивості в різних напрямах неоднакові: слюда легко поділяється на пластівці тільки в одному напрямку (паралельно до її поверхні), в інших напрямках для руйнування слюди потрібно значно більше зусилля. Аморфні речовини плавляться і киплять в інтервалі температур. Охолодження їх не супроводжується утворенням кристалічних структур. Типовими представниками аморфних тіл є звичайне силікатне скло. Аморфні тіла ізотропні, тобто сталість властивостей (теплопровідності, електропровідності, механічних властивостей) проявляється в усіх напрямках однаково.
Властивості кристалічних речовин визначаються особливостями їх кристалічних ґраток, які представляють собою умовний каркас, що утворений з перетинаючи прямих ліній, в центрах перетину знаходяться активні частини. В залежності від природи цих частин розрізняють чотири типи кристалічних ґраток: атомні, молекулярні, іонні, металічні.
Молекулярні кристалічні гратки: в вузлах знаходяться молекули, зв’язані силами міжмолекулярних взаємодій (вандервальсові сили). Сили ці порівняно слабші від електростатичних або від сил ковалентних зв’язків, тому речовини з молекулярним типом ґратки мають малу твердість, низькі температури плавлення і кипіння, їхні розчини мають малу електропровідність. До таких речовин належать органічні сполуки, вода (лід), карбон (ІV) оксид (сухий лід).
Атомні кристалічні ґратки: побудовані з атомів, які зв’язані ковалентним зв’язком. Усі зв’язки в таких кристалах рівноцінні і дуже міцні, тому речовини з атомними кристалічними ґратками є дуже тверді, з високою температурою кипіння, поганою розчинністю. До таких речовин належать алмаз, графіт, силіцій, карборунд та ін.
Іонні кристалічні ґратки: в вузлах знаходятьсяпозитивно і негативно заряджені іони, які зв’язані між собою силами електростатичного протягування. Такі ґратки мають більшість солей і деякі оксиди, до складу яких входять елементи з дуже різною електронегативністю. Речовини з іонною кристалічною граткою мало леткі, з високою температурою плавлення, їхні розплави і розчини добре проводять електричний струм.
Металічні ґратки відрізняються від усіх розглянутих типів. У вузлах ґраток типових металів містяться позитивно заряджені іони, між якими рухаються електрони в особливому, так званому вільному, стані. Вони неначе скріплюють однойменно заряджені іони металу у дуже щільну кристалічну решітку. В свою чергу, самі електрони утримуються іонами металу і не можуть вільно покинути решітку. За рахунок вільних електронів метали характеризуються електропровідністю, теплопровідністю, ковкістю.
На Рис. 2 наведено схеми кристалічних ґраток різних типів. Міцність зв’язку між часточками, що утворюють кристали, характеризується енергією, яку потрібно витратити для зруйнування кристалічної ґратки і віддалення частинок, з котрих вона складається, на таку відстань, при якій вони вже не взаємодіють. Цю величину називають енергією кристалічної ґратки і виражають у кДж/моль речовини. Чим вища енергія кристалічної решітки, тим міцніший кристал. Так, для NaCl ця енергія становить 771 кДж/моль, а для KJ – 687 кДж/моль.
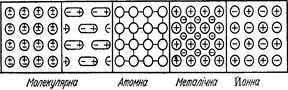 Рис. 2. Схеми кристалічних ґраток різних типів.
Рис. 2. Схеми кристалічних ґраток різних типів.
|
Кристалічні ґратки руйнуються при плавленні, випаровуванні і розчиненні твердих речовин. Усі ці процеси потребують витрати енергії, величина якої залежить від енергії кристалічної решітки. Процес переходу твердої речовини у рідину при певній температурі називають плавленням. Перехід твердих тіл у газоподібний, минаючи рідкий стан, – сублімацією (випаровування йоду, сухого льоду).
ПИТАННЯ ДЛЯ САМОСТІЙНОГО КОНТРОЛЮ:
1. Охарактеризувати газоподібний, рідкий і твердий стан речовини.
2. Поняття про ідеальний газ. Якими параметрами визначається фізичний стан ідеального газу?
3. Сформулювати закон Бойля-Маріотта і написати формулу залежності об’єму газу від тиску.
4. Сформулювати закон Гей-Люссака і написати формулу залежності об’єму газу від температури.
5. Сформулювати закон Шарля і написати формулу залежності тиску газу від температури.
6. Написати рівняння Клапейрона-Менделєєва і пояснити зміст.
7. Написати рівняння Ван-дер-Ваальса для реальних газів.
8. Що таке критична температура?
9. Поняття про критичний стан газу.
10. Поняття про ізотропність речовини.
11. Фізико-хімічний зміст поверхневого натягу.
12. Дати характеристику вільної поверхневої енергії.
13. Написати формулу, за якою розраховують величину поверхневого натягу.
14. Поняття про поверхнево-активні та поверхнево-неактивні речовини.
15. Біологічне значення поверхневого натягу.
16. Що таке критична температура для рідин?
17. Поняття про насичену пару і тиск насиченої пари, випаровування і кипіння.
18. Явище анізотропії для кристалічних тіл.
19. Типи кристалічних решіток.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 2445; Нарушение авторских прав?; Мы поможем в написании вашей работы!