
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Проста речовина. Оксиген входить до складу більшості природних неорганічних та органічних речовин
|
|
|
|
Поширення в природі
Оксиген входить до складу більшості природних неорганічних та органічних речовин. Відомо близько 1400 мінералів, які містять оксиген. У зв'- язаному стані на Землі він є у гідросфері (85,82 % (мас.)) і літосфері (47 % (мас.)). До важливих кисневмісних мінералів належать кварц та його модифікації (вміст кисню 53 % (мас.)), алюмосилікати (польові шпати, слюди, глина — 56 % (мас.)), вапняки тощо, а також речовини тваринного і рослинного походження (наприклад, в організмі людини міститься до 65 % (мас.) оксисену).
У вільному стані Оксиген є в атмосфері (23,1 % (мас.) або 20,95% (об.)), що становить 1,5-1015 т. Зазначена кількість не перевищує 0,0001 загального вмісту оксигену в земній корі. Оксиген повітря витрачається на процеси горіння, дихання, гниття, іржавіння й водночас він безперервно регенерується завдяки фотосинтезу:
nСO2 + mН2O 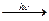 Сn(Н2O)m + nO2.
Сn(Н2O)m + nO2.
Добування. Основним промисловим методом добування кисню є виділення його з повітря за допомогою скраплення останнього та фракційної дистиляції. Оскільки кисень є газом, щоб його перевести у рідкий стан газ необхідно спочатку охолодити до температури, нижчої за критичну, яка досить низька (-118 °С), а потім піддати дії високого тиску.
Кисень має вищу температуру кипіння (-183°С) порівняно з азотом (-196°С), тому під час дистиляції азот випаровується і збирається для використання, а кисень залишається в рідкому стані в нижній частині ректифікаційної колони. Такий кисень містить незначні домішки азоту, вуглекислого газу ти близько 3 % аргону, який має близьку до кисню температуру кипіння (-186 °С).
Кисень високого ступеня чистоти добувають електролізом води. Цей метод використовують переважно для добування водню (катодний процес), але одночасно на аноді одержують другий корисний продукт - кисень.
Лабораторні методи добування кисню ґрунтуються на розкладі багатих на нього, але відносно нестійких хімічних сполук. Наприклад, кисень можна одержати під час термічного розкладу перманганату калію КМnО4, хлорату калію КСlO3 (за наявності каталізатора, наприклад МnO2, Fe2О3, Сr2О3), нітратів, оксидів металів тощо:
2KC1O3 ® 2KC1 + 3O2;
2KMnO4 ®K2MnO4 + MnO2 + O2;
2KNO3 ®2KNO2 + O2;
2HgO ® 2Hg + O2.
Зручним способом лабораторного добування кисню є розклад гідроген пероксиду за наявності каталізатора МnО2:
2Н2О2 = 2Н2О + О2.
Фізичні властивості. Вільний кисень складається з двохатомних молекул O2. Внаслідок ковалентної природи зв'язку кисень є типовим газом з низькими температурами кипіння (-183°С) та плавлення (-218,7°С). Газоподібний кисень безбарвний, не має запаху і смаку, у рідкому та твердому станах має блідо-синє забарвлення.
Низькі температури кипіння і плавлення кисню пояснюють тим, що молекула О2 неполярна і має малу здатність до поляризації. Це зумовлює існування в конденсованих станах речовини лише слабких сил дисперсійної міжмолекулярної взаємодії, які легко долаються вже за відносно низьких температур. Саме тому неполярні і малополяризовані молекули кисню мають низьку розчинність у поляризованій воді.
Довжина хімічного зв'язку в молекулі О2 становить 120,7 нм, що істотно менше за довжину одинарного ковалентного зв'язку О—О. Наприклад, у молекулі Н—О—О—Н вона становить 149 нм. Згідно з цим енергія зв' язку в молекулі O2 велика і становить 494 кДж/моль, що значно перевищує енергію одинарного зв’язку О—О (в молекулі Н—О—О—Н вона становить 210 кДж/моль.) Цим пояснюють той факт, що дисоціація молекул кисню на атоми розпочинається лише за температури понад 1500°С. Вона може відбуватися також у разі вбирання ультрафіолетового випромінювання (фотоліз). Тому біля земної поверхні кисень в атмосфері перебуває у молекулярному стані О2, а вище за 100 км основною формою існування кисню стає атомарний. Молекули О2 розщеплюються тут на атоми під впливом ультрафіолетового випромінювання Сонця.
Молекула кисню парамагнітна, наявність парамагнетизму відповідає розміщенню на молекулярній орбіталі двох неспарених електронів. Внаслідок парамагнетизму рідкий і твердий кисень притягається магнітним полем.
Утворення хімічних зв' язків у молекулі О2 та деякі її властивості пояснює метод молекулярних орбіталей. Так, мала-довжина зв' язку між атомами О-О та висока його енергія зумовлені тим, що кратність зв' язку в молекулі кисню О2 дорівнює 2.
Парамагнітні властивості молекули О2 спричинені наявністю двох неспарених електронів, які, за правилом Хунда, займають дві окремі вироджені розпушувальні молекулярні орбіталі. Атом кисню порівняно з молекулою має більшу енергію іонізації (відповідно 1313 і 1165 кДж/моль), оскільки у разі іонізації молекули О2 електрон відщеплюється з енергетично вищої (ніж атомні) розпушувальної молекулярної орбіталі. Утворення молекулярних іонів О2+, О2-та О22- можливе тому, що число зв'язувальних електронів перевищує число розпушувальних (кратність зв’язку більша за нуль).
Кисень має алотропну модифікацію — озон О3.
Хімічні властивості. Кисень характеризується високою хімічною активністю і належить до типових окисників. Він реагує з більшістю простих речовин, найчастіше утворюючи оксиди, в яких має ступінь окиснення -2. Такі реакції зазвичай відбуваються з досить великою швидкістю лише за підвищених температур, оскільки потребують активації молекул О2:
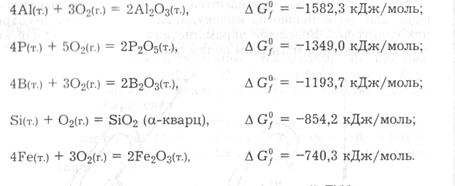
Оксиди можуть утворюватися не лише під час окиснення киснем простих речовин. Багато складних речовин за певних умов також взаємодіє з киснем. При цьому утворюються оксиди елементів, а іноді й оксиди, і прості речовини, наприклад:

Здебільшого реакції окиснення відбуваються з достатньою швидкістю лише за підвищеної температури, оскільки потрібна деяка енергія для активації молекул O2. Якщо окиснення речовин відбувається енергійно, з виділенням великої кількості теплоти і світла, то такі процеси називають горінням. Вони відбуваються, як правило, за умови надлишку повітря або чистого кисню і завершуються утворенням кінцевих продуктів окиснення (СО2, Н2О, SО2, Р2О5, N2 тощо). Наприклад, під час горіння ацетилену в середовищі кисню температура полум'я досягає 3200°С.
Класифікацію основних типів неорганічних сполук кисню за ступенями його окиснення подано наведеною нижче схемою:
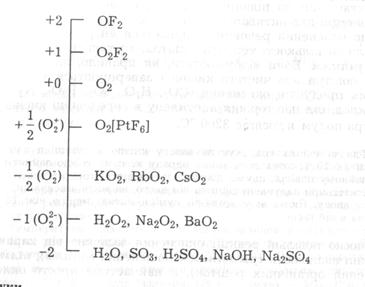
Оксиди. Загальні методи добування оксидів вам відомі із курсу хімії середньої школи.
В оксидах неметалів різниця між електронегативностями атомів кисню і неметалу невелика, тому хімічний зв' язок у них ковалентний полярний. В оксидах неметалів валентні орбіталі атомів кисню найчастіше перебувають у стані sр3-гібридизації.
Оксиди неметалів за хімічною природою кислотні. Більшість із них розчиняється у воді з утворенням відповідних кислот, тому їх називають ангідридами кислот:
СO2 + Н2O «Н2СO3;
SО3 + Н2О «Н2SО4.
Оксиди найактивніших металів мають переважно іонний зв'язок і за хімічною природою основні. До найтиповіших з них належать оксиди лужних і лужноземельних металів, їм відповідають гідроксиди, які є сильними основами.
У міру зростання ступеня окиснення металу збільшується частка ковалентності в його хімічному зв'язку з киснем. Такі оксиди з іонно-ковалентним зв'язком амфотерні, їм відповідають амфотерні гідроксиди, здатні дисоціювати за типом слабких основ за місцем зв' язку Ме —ОН і за типом слабких кислот — за місцем зв' язку МеО—Н. До таких оксидів належать переважно оксиди металів, які мають відносно невелику електронегативність, наприклад А12О3, Сr2О3, РbО, ZпО, Fе2О3 тощо. Залежно від умов вони виявляють властивості основних або кислотних оксидів. Амфотерні оксиди з водою не взаємодіють (не розчиняються), але можуть реагувати як з кислотами, так і з лугами, а під час нагрівання — з основними та кислотними оксидами з утворенням солей.
Оксиди металів (d-елементів) з високими ступенями окиснення мають ковалентний характер зв' язків між атомами в молекулах (СrО3, Мn2О7, Rе2О7, ОsО4 тощо). Частина з них розчиняється у воді з утворенням гідратів, які дисоціюють за типом кислот за місцем найбільш полярного зв' язку Н—О:

Перелічені оксиди мають кислотну природу і також належать до ангідридів кислот.
Перехідні елементи здатні утворювати нестехіометричні оксиди, їхні кристалічні ґратки складаються зі щільно упакованих іонів оксиду, а частина пустот такої структури заповнена іонами металу, наприклад FеО1-x (х= 0,05-0,10). Існують також неcтехіометричні оксиди, у кристалічних ґратках яких пустоти наповнені надлишковим, тобто надстехіометричним киснем, наприклад U2+Х (х = 0,00—0,30).
На початкових стадіях реакцій металів з киснем можуть утворюватися субоксиди — сполуки з металічним зв' язком. Вони є продуктом вкорінення атомів оксигену в кристалічні ґратки металів, наприклад Ті6О, Ті3О.
Хімічні властивості води. Відносно нагрівання вода є досить, стійкою сполукою. Вона практично не розкладається під час нагрівання до температури 1200°С, і тільки за вищих температур дисоціює на атом Н і групу -ОН. За температури 5000°С вода розкладається з вибухом.
Відносно різноманітних хімічних сполук вода поводить себе як досить активний реагент. Вона може реагувати з речовинами як неорганічного, так і органічного походження. Під час взаємодії з ними вона може руйнуватися або залишатися незмінною.
Найхарактернішими для води є хімічні реакції, наведені нижче.
1. Приєднання основних та кислотних оксидів з утворенням основ і кислот:

2. Приєднання до основ, кислот і солей з утворенням кристалогідратів, наприклад: КОН×Н2О, Н2SО4×2Н2О, Nа2SО4×10Н2О.
3. Окиснення за рахунок водню в ступені окиснення +1 сильних відновників за звичайних умов або за високої температури

4. Відновлення за рахунок кисню в ступені окиснення -2. Наприклад, водяна пара горить у середовищі фтору:
F2 + Н2О = 2НF + О.
5.Участь у донорно-акцепторних взаємодіях. За рахунок донорних властивостей атома оксигену, який має дві неподілені пари електронів, вода часто відіграє роль ліганда в реакціях комплексоутворення. Вона може бути і донором протона, тому в кислотно-основних перетвореннях відіграє роль амфоліту:
Н+ + Н2О «Н3О+.
Згідно з протонною теорією кислот і основ Й. Н. Бренстеда (1879-1947) в цій реакції вода є основою. Відносно електролітів, здатних приєднувати протон, вода поводить себе як кислота, наприклад:
NН3 + Н2О «NH4+ + ОН-.
Вона утворює велику кількість аквакомплексів:
Сu2+ + 4Н2О=[Сu(Н2О)4]2+;
Сr3+ + 6Н2О = [Сr(Н2О)6]3+.
Вода може не лише створювати середовище, а й бути безпосереднім учасником окисно-відновних реакцій:
С12 + Н2О «НС1 + НОСl;
2КМnО4 + 3К2SО3 + Н2О = 2МnО2 + 3К2SО4 + 2КОН.
Чиста вода є дуже слабким електролітом і майже не проводить електричний струм. Іонний добуток води за температури 22 °С відповідає стану рівноваги:
Н2О «Н+ + ОН-,
і дорівнює Кв = [Н+][ОН-] = 10-14.
У водних розчинах зазначену рівновагу дисоціації можна змінювати у той чи інший бік не лише розчиненням у воді кислот і лугів, а й солей слабких кислот або основ (гідроліз солей):
Fе3+ + Н2О «FеОН2+ + H+;
РО43- + Н2О «HРО42-+ ОН-.
Внаслідок цих реакцій змінюється концентрація протонів або гідроксил-іонів.
Відомо багато сполук, які повністю розкладаються водою, наприклад:
Аl2S3 + 6Н2О = 2А1(ОН)3 + 3Н2S;
РС13 + 3Н2О = Н3РО3 + 3НС1.
Гідроген пероксид. Пероксид водню є однією з найважливіших сполук кисню. У промисловості його добувають електрохімічними та хімічними способами. Для електрохімічного добування Н2О2 використовують розчини сірчаної кислоти або її солей (зокрема, (NН4)2SО4). У цьому разі електролізу піддають 50 %-й розчин Н2SО4 за високої густини струму та охолодження. За таких умов на платиновому аноді окиснюються гідросульфат-іони до пероксодисірчаної кислоти Н2S2О8:
2НSО4- = Н2S2О8 + 2е.
Слабке нагрівання розчину Н2S2О8 сприяє перебігу процесу гідролізу, внаслідок чого утворюється Н2О2:
Н2S2О8 + 2Н2О = Н2О2 + 2Н2SО4.
Хімічні методи добування Н2О2 ґрунтуються на окисненні киснем органічних сполук, наприклад таких, як алкільні похідні антрагідрохінону та ізопропіловий спирт.
Пероксид водню легко утворюється з пероксиду барію під дією на нього розбавленого розчину сірчаної кислоти:
ВаО2 + Н2SО4 = Н2О2 + ВаSО4.
Молекула Н2О2 нелінійна, два зв’язки О-Н розміщені у двох площинах під кутом 120°:

Внаслідок несимметричного розміщення зв’язків О-Н молекула Н2О2 дуже полярна. Наявність неподілених електронних пар у атомів оксигену створює можливість донорно-акцепторної взаємодії. Так, подібно до води, пероксид водню може входити до складу кристалічних речовин, наприклад Ка2СО3×1,5Н2О2×Н2О.
У водних розчинах пероксид водню є слабкою кислотою:
Н2О2 «Н+ + НО-, К = 2,24×10-12,
але сильнішою за воду. Під час взаємодії його розчинів з лугами можна виділити відповідні пероксиди металів, які належать до класу солей (а не оксидів), наприклад:
Н2О2 + Ва(ОН)2 = ВаО2 + 2Н2О.
На відміну від нормальних оксидів, які з кислотами утворюють сіль і воду, пероксиди в подібних реакціях дають сіль і пероксид водню, наприклад:
ВаО + Н2SО4 = ВаSО4 + Н2О;
ВаО2 + Н2SО4 = ВаSО4 + Н2О2.
Пероксиди металів як солі слабкої кислоти у водному розчині нестійкі. Це зумовлено їх сильним гідролізом та розкладом Н2О2 у лужному середовищі:
Na2O2 + 2H2O = 2NaOH + H2O2;
2H2O2 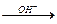 2H2O + O2.
2H2O + O2.
Пероксиди в окисно-відновних реакціях можуть перетворюватись згідно з такою схемою:

Прикладом може бути характерна для пероксиду водню реакція розкладу за типом диспропорціювання (окисно-відновна реакція самоокиснення — самовідновлення):
2Н2О2 = 2Н2О + О2.
Отже, Н2О2 здатний виявляти властивості як окисника, так і відновника, що властиво сполукам з проміжними ступенями окиснення елементів. Окисна та відновна активності Н2О2 характеризуються такими значеннями електродних потенціалів відповідних перетворень:
Н2О2 + 2Н+ + 2е- = 2Н2О, Е° = 1,78 В;
О2 + 2Н+ + 2е- = Н2О2, Е° = 0,68 В.
Порівняння цих електродних потенціалів свідчить про те, що окиснювальна здатність Н2О2 (Е° = 1,78 В) виражена значно сильніше, ніж відновна (Е° = 0,68 В). Справді, пероксиди — сильні окисники. Вони легко окиснюють йодиди до вільного йоду, нітрити — до нітратів, сполуки хрому(ПІ) — до хрому(VІ) тощо, наприклад:
2КІ + Н2О2 + Н2SО4 = І2 + 2Н2О + К2SО4;
2К3[Сr(ОН)6] + 3Н2О2 = 2К2СrО4 + 8Н2О + 2КОН.
Лише під час взаємодії із сильними окисниками Н2О2 виявляє відновні властивості, продуктом його окиснення є кисень, наприклад:
Н2О2 + С12 = О2 + 2НС1;
Н2О2 + О3 = 2О2 + Н2О;
3Н2О2 + 2КМnО4 = 3О2 + 2МnО2 + 2КОН + 2Н2О;
.5Н2О2 + 2КМnО4 + 3Н2SО4 = 5О2 + 2МnSО4 + К2SО4 + 8Н2О.
Останню реакцію використовують у хімічному аналізі для кількісного визначення пероксиду водню.
Озон. Озон О3 - алотропна модифікація кисню. Він утворюється з газоподібного кисню під дією на нього тихого електричного розряду або ультрафиолетового випромінювання. Для штучного добування О3 використовують озонатори. Тихий розряд проходить у просторі між стінками
внутрішньої та зовнішньої скляних посудин. Кисень, який виходить з озонато-ра, містить кілька відсотків озону (до 10 %).
У земній атмосфері озон утворюється під час грозових розрядів, а у верхніх її шарах - під дією ультрафіолетового випромінювання. Географія озону дуже динамічна, на неї впливають повітряні течії — вітри атмосфери. Антициклони зменшують, ациклони збільшують кількість О3 у стратосфері.
Вільний стратосферний озон відіграє дуже важливу роль у природі. Озоновий шар затримує небезпечне для живих істот жорстке короткохвильове сонячне випромінювання. Практична діяльність людини дуже часто призводить до руйнування озонового шару. Серед речовин, які руйнують стратосферний озон, найбільш небезпечним є хлор. Одна молекула хлору здатна знищити до 100 тис. молекул О3 (для порівняння: 1 молекула NО руйнує лише 10 молекул О3).
Озон - отруйний газ синього кольору з різким характерним запахом (tкип = -110°С, tпл = -192,7°С). Рідкий озон має темно-синє забарвлення, твердий - чорне.
Молекула О3 діамагнітна, має кутову будову, що зумовлює її полярність. Крім того, порівняно з киснем вона має більшу поляризованість внаслідок більшого розміру молекули. Енергія міжмолекулярної взаємодії О3 у конденсованих станах перевищує цю величину для молекул О3, тому температури кипіння і плавлення озону вищі, ніж кисню. Довжина зв'язку між атомами кисню (128 пм) проміжна порівняно з одинарним (149 пм) та подвійним (121 пм) зв'язками, тому вважають, що порядок зв' язків у молекулі О3 дорівнює 1,5. Величина валентного кута (116,5°) вказує на sр2-гібридизацію валентних орбіталей центрального атома кисню. Наведені дані свідчать про наявність у молекулі О3 делокалізованого трицентрового p-зв' язку:

При цьому центральний sр2-гібридизований атом оксигену утворює два s-зв'язки з крайніми атомами, а його негібридизована 2рz-орбіталь, яка розміщена під прямим кутом до площини трьох атомів, та аналогічно спрямовані 2рz-орбіталі крайніх атомів оксигену утворюють трицентровий нелокалізований p-зв' язок. Про значно більшу хімічну активність О3 порівняно з О2 свідчать стандартні електродні потенціали озону у водних розчинах:
нейтральне середовище: О3 + Н2О + 2е- = О2 + 2ОН-, Е° = 1,24 В;
О2 + 2Н2О + 4е- = 4ОН-, Е° = 0,401 В;
кисле середовище: О3 + 2Н+ + 2е- = О2 + Н2О, Е° = 2,07 В;
О2 + 4Н+ + 4е- = 2Н2О, Е° = 1,23 В.
Озон легко окиснює різноманітні сполуки з утворенням іона О2- та молекули О2: 2Аg + O3 = Аg2O + O2;
РbS + 4O3 = РbSO4 + 4O2;
2КІ + О3 + Н2О = І2 + О2 + 2КОН.
Останню реакцію використовують для виявлення та кількісного визначення озону. Іноді продуктами реакцій за участю озону є озоніди (спорідненість О3 до електрона становить 180 кДж/моль), наприклад:
К + О3 = КО3;
4КОН + 4О3 = 4КО3 + О2 + 2Н2О. Такі сполуки вміщують молекулярний іон О3-. На відміну від озону Оз іон О3- має неспарений електрон, який зумовлює його парамагнетизм. Озоніди лужних металів мають червоне забарвлення, вони дуже сильні окисники.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1415; Нарушение авторских прав?; Мы поможем в написании вашей работы!