
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Проста речовина
ЛЕКЦІЯ X. ВЛАСТИВОСТІ НЕМЕТАЛІВ. ГІДРОГЕН. ОКСИГЕН. ХАРАКТЕРИСТИКА ЕЛЕМЕНТІВ ТА ЇХ СПОЛУК.
План:
1. Загальна характеристика Гідрогену.
2. Електронна структура Гідрогену.
3. Поширення в природі та способи отримання.
4. Хімічні властивості.
5. Основні хімічні сполуки.
ІІ. Загальна характеристика Оксигену.
1. Характеристика Гідрогену. Електронна формула 1s1. Положення Гідрогену в Періодичній системі неоднозначне. На користь розміщення Гідрогену перед лужними металами свідчать такі аргументи:
1) Як і лужні метали Гідроген виявляє в більшості сполук ступінь окиснення +1.
2) Подібно лужним металам, він має яскраво виражені відновні властивості.
3) Для Гідрогену і металів, у тому числі і лужних, характерні реакції взаємного витіснення.
Схожість Гідрогену з галогенами зумовлена наступним:
1) Як і атоми галогенів, Гідроген може приєднувати електрон з утворенням іону Гідрогену, який є ізоелектронним найближчому інертному газу Гелію.
2) Як і галогени, проста речовина – водень – газоподібна за звичайних умов и молекула водню складається із двох атомів.
3) Гідроген в сполуках заміщується галогенами. Багаточисельні приклади таких реакцій є в органічній хімії (галогенування насичених вуглеводнів).
4) Потенціал іонізації Гідрогену близький за значенням до потенціалів іонізації галогенів. Так І(Н)=13,6 еВ, а І(F)=17,4 еВ, однак I(Li)=5,6 еВ.
Оскільки Гідроген значно відрізняється за властивостями від лужних металів та галогенів, віднесення його до тієї чи іншої групи умовно.
2. Поширення в природі та способи отримання. Водень є дуже поширеним у природі елементом. У земній корі, включаючи атмосферу, гідросферу й літосферу, його вміст становить 0,15 % (мас.) або 3,0 % за числом атомів (мольних часток у відсотках). Водночас він надзвичайно поширений у Всесвіті. Спектральним аналізом доведено, що у фотосфері Сонця міститься близько 84 % водню. Він є головним компонентом поверхневих речовин великих планет Сонячної системи - Юпітера, Сатурна, Урана, а також білих і блакитних зір. Водень – це «космічне атомнепаливо», джерело енергії Сонцяі зір. За оцінками поширеності елементів у Всесвіті, його вміст перевищує 70 % (мас.).
Добування. Сировинна база для добування водню практично невичерпна, тому обсяги його одержання зумовлюються лише попитом та енергетичними можливостями. Розроблено кілька різних способів його добування у промисловості, причому відповідно до потреб використовують найдоцільніші і найдешевші з них. Переважна більшість способів добування водню ґрунтується на принципі його відновлення з хімічних сполук.
· Залізопаровий спосіб був розроблений у 1783 р. французьким хіміком А. Лавуазьє й історично є першим способом добування водню. Він полягає у відновленні водню з водяної пари залізом за високої температури:
4H2O + 3Fe 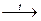 Fe3O4 + 4H2
Fe3O4 + 4H2
· Відновлення води вуглецем. За температури понад 1000°С водяна пара взаємодіє з розжареним коксом з утворенням водяного газу, який єсумішшю водню з оксидом вуглецю(ІІ):
Н2О + С = СО + Н2.
Водень відокремлюють від домішок (СО2, N2, СО) охолодженням одержаної газової суміші скрапленим повітрям за температури -200°С. За цим способом добувають дуже чистий водень, який використовують у харчовій промисловості для гідрогенізації жирів. Найчастіше водяний газ разом з водяною парою за температури 400°С пропускають над каталізатором (оксид заліза чи кобальту), внаслідок чого оксид вуглецю(П) взаємодіє з водою і перетворюється на вуглекислий газ (так звана конверсія СО):
СО + Н2О(пара) = СО2 + Н2.
· Взаємодія метану з водяною парою. Для синтезу аміаку і гідрування вугілля водень добувають також за реакцією високо- температурної (~1100°С) взаємодії метану з водяною парою за сталого тиску:
СН4 + Н2О(пара) = СО + 3Н2, DН = 206,2 кДж.
Ця реакція ендотермічна і потребує затрат теплоти. Водень одержують, застосовуючи «внутрішнє згоряння», для чого до суміші газів додають кисень, щоб частина метану згоріла до СО2:
СН4 + 2О2 = СО2 + 2Н2О(пара), DН = -802,2 кДж.
Врешті-решт співвідношення між компонентами реакційної суміші добирають таким, щоб процес був слабко екзотермічним:
12СН4 + 5Н2О(пара) + 5О2 = 29Н2 + 9СО + 3СО2, DН = -67,2 кДж.
· Електрохімічний розклад води. Вода має дуже низьку електропровідність, тому з метою зменшення енерговитрат у промисловості для проведення електролізу використовують лужні розчини. При цьому на електродах, які виготовляють із заліза або нікелю, відбуваються такі процеси:
Катод: 2Н2О + 2е = Н2 + 2ОН-, Е° = -0,83 В;
Анод: 4 ОН- = О2 + 2Н2О + 4е, Е° = 0,401 В.
Процес електрохімічного розкладу води дуже енергомісткий. Теоретично для добування 1 м3 водню за нормальних умов потрібно затратити близько 2,8 кВт×год електроенергії. Насправді ж її затрати майже вдвічі більші внаслідок перенапруги на електродах та омічного опору електроліту й діафрагми.
Інші способи добування водню з води мають лабораторне значення, оскільки їх використовують за умов, коли потрібні невеликі його об' єми.
· Взаємодія деяких металів з розчинами кислот. Ці реакції найпростіші для лабораторного добування водню, їх використовував ще Г. Кавендіш. Прикладом є взаємодія цинку з розчином хлоридної кислоти:
Zn + 2НС1 = ZnС12 + Н2.
Водень за цим способомдобувають в апараті Кіппа у середню кулю якого завантажують гранульований цинк. Для очищення водень пропускають крізь підкислений розчин KMnO4 або K2Cr2O7, а для висушування – крізь концентровану H2SO4.
· Взаємодія гідриду кальцію з водою належить до окисно-відновних реакцій диспропорціонування, оскільки відновником катіона Гідрогену виступає негативно заряджений гідрид-іон Н‑:
-1 +1 О
СаН2 + 2Н2О = Са(ОН)2 + 2Н2.
Для добування 1 м3 водню за цією реакцією потрібно всього 0,94 кг гідриду кальцію СаН2. Ще менше, всього 0,357 кг гідриду літію під час взаємодії з водою утворюють 1 м3 водню. З цієї причини його застосовують у рятувальних жилетах пілотів морської авіації.
· Взаємодією лужних і лужноземельних металів із водою можна подати такими реакціями:
2Nа + 2Н2О ® 2NаОН + Н2;
Са + 2Н2О ® Са(ОН)2 + Н2.
· Взаємодією алюмінію ібо кремнію з їдкими лугами описують такі рівняння:
2Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2;
Si + 2NaOH + H2O ® Na2SiO3 + 2H2.
Для добування 1 м3 водню за цими способами потрібно 0,81 кг алюмінію або 0,63 кг кремнію, тому останній спосіб економніший.
Фізичні властивості. Газоподібний водень складається з двохатомних молекул Н2. Він безбарвний і не має запаху. Утворення молекул водню з атомів супроводжується виділенням великої кількості теплоти:
2Н = Н2, DН = -432,1 кДж,
що є свідченням великої енергії зв' язку Н—Н і значної стійкості цієї молекули.
Молекула водню має дуже малі розміри. Це зумовлює той факт, що за звичайної температури і не дуже високого тиску водень поводить себе майже як ідеальний газ, підпорядковується законам Бойля—Маріотта і Гей-Люссака, а отже, і рівнянню газового стану рV=пRТ. Оскільки малі молекули водню не здатні до значної деформації, то між ними не виникають помітні сили взаємодії. Наслідком цього є надзвичайно низька температура кипіння водню, яка становить лише -252,8°С (20,4 К). У значних кількостях скраплений водень вдалося одержати лише у 1898 р. (через 130 років після його відкриття) англійському фізику Дж. Дьюару (1842-1923), чиїм ім' ям було названо посудину для вберігання скраплених газів.
Молекулярний водень дуже погано розчиняється у воді та інших розчинниках. За температури 18°С його розчинність становить 1,85 об'єму в 100 об' ємах води.
Водень - найлегший з відомих газів: маса 1 м3 водню становить 0,09 кг (для порівняння: 1 м3 гелію вдвічі важчий).
Природний водень складається з трьох нуклідів: протію 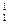 Н, дейтерію
Н, дейтерію 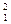 Д і тритію
Д і тритію 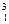 Т. Вміст дейтерію становить близько 0,02 % (об.) порівняно з протієм і мало впливає на фізичні властивості водню. Тритій є радіоактивним нуклідом з періодом піврозпаду 12,5 року і в природному водні відсутній.
Т. Вміст дейтерію становить близько 0,02 % (об.) порівняно з протієм і мало впливає на фізичні властивості водню. Тритій є радіоактивним нуклідом з періодом піврозпаду 12,5 року і в природному водні відсутній.
3. Хімічні властивості. Атом гідрогену в основному стані має електронну конфігурацію 1s1, яка є найпростішою. Наявність тільки одного валентного електрона на одній валентній орбіталі відповідає його здатності в усіх сполуках бути одновалентним. Сполуки, число яких у водню найбільше порівняно з іншими елементами, можуть утворюватися з виникненням ковалентного зв язку, коли спільна електронна пара з атомом якогось неметалу певною мірою зміщується у бік більш електронегативного елемента. Можуть також утворюватись іонні сполуки з найактивнішими металами — лужними, лужноземельними, а також лантаноїдами, з якими водень, приєднуючи електрон, перетворюється на однозарядний негативний іон. Із d-металами він утворює металоподібні сполуки, в яких електрони водню залучаються до спільної системи металічного зв' язку.
Водневі сполуки мають низку цікавих особливостей та аномалій, пов'- язаних, зокрема, з утворенням водневого зв'язку, донорно-акцепторними взаємодіями, трицентровим зв' язком, тощо.
Високий потенціал іонізації (13,6 еВ) і низька спорідненість до електрона (0,715 еВ) свідчать про порівняно невелику хімічну активність цього елемента. У хімічних реакціях водень поводить себе як неметал. Його електронегативність становить 2,1.
· У сполуках знайтиповішими неметалами його атом поляризований позитивно й, отже, йому відповідає ступінь окиснення +1.
· У сполуках з металами та слабко електронегативними неметалами атом водню поляризований негативно і має ступінь окиснення -1.
|
|
Дата добавления: 2014-11-16; Просмотров: 1105; Нарушение авторских прав?; Мы поможем в написании вашей работы!