
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Іонний добуток води. Водневий показник середовища
|
|
|
|
Всі фізіологічні процеси в рослинах і організмах тварин відбуваються у водному середовищі при певній концентрації водневих іонів. Вода, яка є слабким електролітом, в незначній мірі дисоціює на іони:
Н2О ® Н+ + ОН-
Оскільки цей процес є оберненим, до нього можна застосувати закон діючих мас і знайти вираз константи дисоціації води:
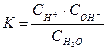
К - константа дисоціації води, дорівнює 1,8 . 10-16 при 220С;
СН2О - концентрація недисоційованих молекул води, яку внаслідок малої дисоціації води можна вважати сталою і такою, яка дорівнює загальному числу грам-молекул води в одному літрі; тобто 1000/18 = 55,56 моль/ л,
СН+, СОН- - відповідно концентрація водневих і гідроксильних іонів в грам-іонах на літр розчину.
Якщо перенести сталі величини К і СН2О по один бік рівняння, то отримаємо вираз:
СН+. СОН- = К . СН2О,
де добуток двох сталих величин К і СН2О також являє собою сталу величину, яку позначимо КВ.
Таким чином, добуток концентрації водневих і гідроксильних іонів (точніше, активності) при даній температурі є величина стала і називається іонним добутком води.
При 220С іонний добуток води КВ дорівнює 10-14. У дистильованій воді концентрації водневих і гідроксильних однакові:
СН+ = СОН- = Ö10-14 = 10-7 моль/л.
Величина іонного добутку КВ є сталою не тільки для води, але і для будь-яких розбавлених водних розчинів, в тому числі для розчинів кислот, лугів. Тому, якщо відома концентрація іонів Н+, легко визначити концентрацію ОН- і навпаки:
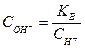
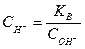
Оскільки підвищення концентрації іонів водню спричиняє відповідне зменшення концентрації гідроксид-іонів, і навпаки, а добуток їх концентрацій (при 220С) залишається завжди рівним 10-14, тому через концентрації іонів водню або гідроксид-іонів можна виразити кислотність і лужність (реакцію) розчину. Так, якщо:
СН+ = 10-7 = СОН- - реакція нейтральна.
СН+ > 10-7 > СОН- - реакція кисла.
СН+ < 10-7 < СОН- - реакція лужна.
Однак, на практиці, щоб уникнути незручностей, пов'язаних із застосуванням чисел з від'ємними показниками ступеню, реакцію середовища звичайно характеризують за допомогою водневого показника.
Водневий показник, позначений як рН, являє собою від'ємний логарифм концентрації водневих іонів:
рН = -lgСН+. (40)
Для абсолютно чистої води при 220С рН = 7, для кислих рідин рН<7, а для лужних рН>7. Зв'язок між концентраціями ОН- і Н+, величиною рН і реакцією середовища можна відобразити наступним співвідношенням:
СОН- 10-14 10-13 10-12 10-11 10-10 10-9 10-8 10-7 10-6 10-5 10-4 10-3 10-2 10-1 10-0
СН+ 10-0 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-1310-14
рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Іонний добуток води при 220С: СН+ . СОН- = 10-14.
Приклад. Обчислити рН 0,1н розчину НNO3 з урахуванням коефіцієнта активності.
Рішення: HNO3 ® H+ +NO-3
pH = -lg aH+; aH+ = CH+. fH+.
Іонна сила розчину:
m= 1/2 (СН+. Z2н+ + CNO3-. Z2 NO3-) = 1/2 (0,1.1 + 0,1.1) = 0,1.
Знайдене значення m відповідає fH+ = 0,78.
aH+ = 0,1. 0,78 = 0,078 = 7,8 . 10-2
pH = -lg 7,8 .10-2 = 2 - lg 7,8 = 2 - 0,89 = 1,11.
Таким чином, для 0,1н розчину HNO3 наявне значення водневого показника дорівнює 1,11, а в аналітичне рН = 1, (- lgCH+ = -lg0,1 = 1).
Водневі іони займають особливе положення серед інших іонів завдяки різко вираженому впливу на різноманітні хімічні і фізіологічні процеси, що відбуваються в розчинах. Наприклад, вплив рН на фізіологічні процеси настільки великий, що вже незначна зміна рН може помітно змінити швидкість процесу або зовсім припинити його.
Так, оптимальність дії ферментів залежить від рН середовища: фермент пепсин найбільш активний при рН = 1,5, фермент птіалін при рН = 6,7. Діяльність ґрунтових мікроорганізмів знаходиться в залежності від рН ґрунтового розчину. Наприклад, активна фіксація азоту мікробами спостерігається при рН = 7,2. Величина рН середовища впливає на зростання і розвиток рослин. Встановлено, що оптимум зростання картоплі знаходиться в межах рН від 5 до 6,5, жита - від 5 до 7, вівса - 5-6,5, пшениці - 6,5-7,5, люцерни - 6,5-7,5. рН крові людини коливається в межах від 7,3 до 7,4. Навіть невеликі відхилення від цієї величини спричиняють зміну в нормальній життєдіяльності організму. Величина рН впливає на протікання важливих ферментативних процесів в гідролізній промисловості і виноробстві, при переробці молочних продуктів, плодів, при заготівлі і тривалому зберіганні кормів і т.д. Під впливом водневих іонів змінюються основні фізико-хімічні властивості речовин і розчинів: розчинність, фільтрація, діаліз, поверхневий натяг, в'язкість, стійкість, набухання і т.д. Тому дуже важливо підтримувати сталість величини рН, останнє зумовлене наявністю буферних систем в рослинних і тваринних організмах і ґрунті.
6. Гідролізом солей називається реакція їхньої обмінної взаємодії з водою:
сіль + вода Û основа + кислота
сіль + вода Û основа + кисла сіль
сіль + вода Û кислота +основна сіль,
яка веде до утворення більш слабкого електроліту, чим вихідна сіль (тобто слабкі кислоти, слабкі основи і іони типу НАn- і KOHn+).
В залежності від сили кислоти і основи, що утворюють солі, можна виділити чотири типи гідролізу:
| Кислоти | |||
| Сильні | Слабкі | ||
| Основи | Сильні | I. NaCl, KNO3 | II. Na2CO3, K2S |
| Слабкі | III. ZnCl2, Al(NO3)3 | IV.СН3СООNH4, Al2S3 |
· Солі першого типу гідролізу не піддаються, тому що при їхній взаємодії з водою не можуть бути отримані слабкі електроліти. У системі Н2О Û Н+ + ОН- рівновага не порушується, тому в розчинах цих солей рН=7.
· Гідроліз солей інших трьох типів є, як правило, процесом оборотним. Солі, які утворені багатоосновними кислотами чи багатокислотними основами, гідролізуються ступінчасто, переходячи в першій фазі в кислі чи основні солі.
Гідроліз Na2CO3:
I ступінь 
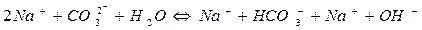
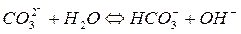
II ступінь 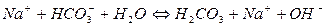
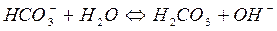
При гідролізі Na2CO3 і інших солей цього типу в розчині накопичуються іони ОН-, які надають йому лужну реакцію з рН>7. Більш сильно виражена перша ступінь гідролізу, чим друга.
Гідроліз ZnCl2:
I ступінь 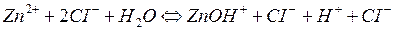
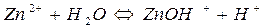
II ступінь 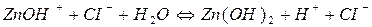
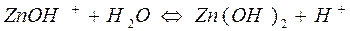
При гідролізі ZnCl2 і інших солей цього типу в розчині накопичуються іони Н+, які надають йому кислу реакцію з рН<7.
Гідроліз СН3СООNH4:
NH4++CH3COO- + H2O Û NH4OH + CH3COOH
Солі цього типу піддаються гідролізу відносно легко. Реакція і рН розчину визначаються відносною силою основ, що утворюються, і кислот. У розглянутому випадку константи електролітичної дисоціації NH4OH і СН3СООН при 25°С відповідно дорівнюють 1,79×10-5 і 1,76×10-5, тому реакція розчину практично нейтральна (рН~7).
Процес гідролізу солей кількісно може бути охарактеризований за допомогою двох величин: ступеня гідролізу (h) і константи гідролізу (Kгідр).
Ступенем гідролізу називається відношення кількості молекул солі, які піддалися гідролізу, до загальної кількості молекул солі в розчині. Ступінь гідролізу h може змінюватися в межах:
гідроліз повний
відсутній гідроліз
0 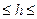 1 в частках одиниці
1 в частках одиниці
0 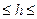 100 в %
100 в %
Константа гідролізу визначає стан хімічної рівноваги в розчині солі, яка гідролізується. Наприклад, для рівноважного стану I ступеня гідролізу Na2CO3 і ZnCl2 , Кгідр. виразиться рівняннями:
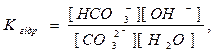
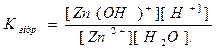
ПИТАННЯ ДЛЯ САМОСТІЙНОГО КОНТРОЛЮ:
1. Визначення „розчину”. Розкрити значення розчинів взагалі і водних розчинів зокрема. Класифікації розчинів.
2. Вказати фактори, які впливають на розчинність твердих речовин у розчинах.
3. Способи вираження складу розчинів.
4. До 300 мл розчину нітратної кислоти з масовою часткою 40% (r=1,25 г/мл) додали 125 мл води. Розрахуйте масову частку кислоти в отриманому розчині. Відповідь: 30%.
5. Хлороводень, що отримали при дії надлишку концентрованої сульфатної кислоти на 29,25 г хлориду натрію, пропустили через 250 мл 2,5 н розчину гідроксиду натрію. Визначити масу солі, що утворилася і реакцію отриманого розчину на лакмус. Відповідь: 29,25 г.
6. Розрахуйте об¢єм розчину гідроксиду натрію з масовою часткою 30% (r=1,33 г/мл), який необхідний для приготування 250 мл розчину з масовою часткою гідроксиду натрію 14% (r=1,15 г/мл). Відповідь: 100,9 мл.
7. В воді масою 128 г розчинили 40 мл метилового спирту, густина якого дорівнює 0,8 г/мл. Визначити молярну концентрацію отриманого розчину, якщо густина його 0,97 г/мл. Відповідь: 6,1 М.
8. Розрахуйте об¢єм розчину з масовою часткою карбонату натрію 15% (r=1,16 г/мл), який потрібний для приготування 120 мл 0,45 М розчину Na2CO3. Відповідь: 32,9 мл.
9. Розрахувати об¢єм 3 М розчину (r=1,12 г/мл), який потрібно додати до води, масою 200 г для приготування розчину з масовою часткою NaCl 10%. Відповідь: 315 мл.
10. Гідроліз солей. Гідроліз в залежності від хімічної природи основ і кислот, що утворюють сіль.
11. Величина рН водного розчину дорівнює 5. Визначити концентрацію іонів водню, аніонів гідроксилу і реакцію середовища.
12. Концентрація іонів водню в розчині дорівнює 8 . 10-6 моль/л. Обчислити рН розчину, рОН і визначити реакцію середовища.
13. Визначити рН 0,1н розчину NaOH, якщо відомо, що ступінь дисоціації 0,85.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 8470; Нарушение авторских прав?; Мы поможем в написании вашей работы!