
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні хімічні сполуки
|
|
|
|
Бінарні сполуки. У реакціях з найактивнішими металами молекулярний водень поводить себе як окисник, відновлюючись, приєднує електрон і перетворюється на негативно заряджений гідрид-іон Н-, який разом із катіоном металу утворює кристалічну іонну солеподібну сполуку. Слід зазначити, що окиснювальна функція для водню малохарактерна. Гідриди металів утворюються під час нагрівання реагентів:
2Lі + Н2 ® 2LiН;
Са + Н2 ® СаН2.
Найстійкішим до нагрівання в інертному середовищі серед гідридів лужних металів є LіН. Взагалі ж гідриди порівняно легко розщеплюються під час нагрівання на метал і водень:
2NаН = 2Nа + Н2.
Гідрид-іон H- порівняно з атомом Н водню має дуже великі розміри, його іонний радіус (136 нм) перевищує іонний радіус фтору (133 нм). Електронна пара гідрид-іона в гідридах металів слабко стабілізована і легко руйнується, але інколи вона може брати участь в утворенні донорно-акцепторного зв' язку, наприклад:
LіН + А1Н3 = Li[AlH4];
2NаН + В2Н6 = 2Nа[ВН4].
Добуті комплексні гідриди також нестійкі. Гідрид Li[А1Н4] широко застосовують в органічній хімії як один з найактивніших гідрувальних агентів.
Гідриди надзвичайно чутливі до вологи і швидко руйнуються за її наявності. Це зумовлено дуже сильно вираженими відновними властивостями гідрид-іонів. За величиною стандартного електродного потенціалу (DЕ 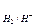 =-2,34 В) гідрид-іон розміщений серед таких найактивніших відновників, як лужні та лужноземельні метали, тому гідриди легко взаємодіють із водою:
=-2,34 В) гідрид-іон розміщений серед таких найактивніших відновників, як лужні та лужноземельні метали, тому гідриди легко взаємодіють із водою:
LiН + Н2О = LiОН + Н2.
Ще легше, з вибухом, вони взаємодіють із кислотами. Деякі з гідридів займаються на повітрі: МgН2 + О2 = МgО + Н2О.
Найхарактернішими для водню є відновні властивості. Вони виявляються переважно відносно металів і деяких оксидів.
Молекулярний водень за звичайних умов малоактивний. Лише зі фтором за будь-яких умов він взаємодіє з вибухом. Із хлором водень взаємодіє при освітленні, з киснем - у разі нагрівання. Він реагує також із бромом, сіркою, йодом, селеном і телуром. З азотом водень реагує лише за нагрівання, високого тиску і наявності каталізатора з утворенням аміаку. Аналогічно він реагує і з вуглецем з утворенням вуглеводнів. Безліч найрізноманітніших органічних сполук утворюється під час взаємодії водню з оксидом вуглецю (II). У цьому разі утворення певної сполуки залежить від умов перебігу реакції.
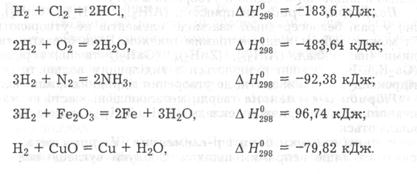
У водному розчині відновні властивості газоподібного молекулярного водню виражені слабко. Саме тому його легко очистити від домішок газів (Н2S, РН3, АsН3) пропусканням крізь підкислені розчини перманганату або дихромату калію.
Відновні властивості атомарного водню або водню в момент виділення виражені значно сильніше. Вже за звичайної температури він відновлює деякі оксиди (СuО, РbО, НgО, Аg2О, Ві2О3), сульфіди та галогеніди. Такий водень утворюється під час пропускання газоподібного молекулярного водню крізь електричну дугу, виділяється з розчинів на поверхні металів у разі взаємодії їх з кислотами або амальгами натрію з водою, а також на катоді під час електролізу водних розчинів електролітів. Атомарний водень може існувати дуже короткий час (0,3-0,5 с), але й цього часу достатньо, щоб взаємодія з реагентом відбулася. Так, якщо в розчин сірчаної кислоти вмістити кілька шматочків металічного цинку, а потім додати розчин перманганату калію, то активний атомарний водень відновлюватиме перманганат, і розчин швидко знебарвиться. Водночас пропускання молекулярного водню крізь підкислений розчин перманганату калію не призводить до відновлення останнього, тому колір розчину не змінюється.
Взагалі хімічна активність атомарного водню настільки висока, що він здатний взаємодіяти із сіркою та азотом уже за звичайної температури.
Швидкість реакцій, що відбуваються за участю водню визначається його станом. Наприклад, процес взаємодії оксиду міді(ІІ) СuО з атомарним воднем відбувається з великою швидкістю за звичайних умов, а з молекулярним воднем за аналогічних умов ця реакція йде надзвичайно повільно, достатню швидкість вона має лише в разі нагрівання.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 562; Нарушение авторских прав?; Мы поможем в написании вашей работы!