
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекція . Окисно-відновні процеси
|
|
|
|
ЛЕКЦІЯ VIIІ. ОКИСНО-ВІДНОВНІ ПРОЦЕСИ.
План:
1. Основні поняття окисно-відновних процесів.
2. Окисно-відновні властивості простих речовин та сполук елементів.
3. Типи окисно-відновних реакцій.
4. Фактори, що впливають на перебіг окисно-відновних реакцій.
5. Складання рівнянь окисно-відновних реакцій.
За зміною ступеня окиснення елементів, які входять до складу реагуючих речовин та продуктів їх взаємодії, хімічні реакції ділять на дві групи. До першої групи належать реакції, які перебігають без зміни ступеня окиснення елементів. Продукти реакції у даному випадку утворюються внаслідок перегрупування атомів чи іонів. До них належать реакції:
обміну BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
полімеризації 2N02 → N2O4
комплексоугворення HgI2 + 2КІ = K2[HgI4]
сполучення (деякі реакції) CaO + H2O = Ca(OH)2
термічного розкладу MnCO3 = MnO + CO2
До другого типу належать реакції, які перебігають зі зміною ступеня окиснення елементів. Такі реакції називають окисно-відновними:
0 +1
Mn + 2 Н20 = Mn(OH)2 + H2.
У 1905-1914 роках російські хіміки JI. В. Писаржевський, А. І. Михайленко, С. О. Даїн, М. О. Шилов сформулювали теорію окисно-відновних реакцій.
Окисно-відновними називають реакції, які супроводжуються переходом електронів від одних молекул або іонів до інших, внаслідок чого змінюється ступінь окиснення елементів.
1. Основні поняття окисно-відновних процесів. Речовину, яка містить елемент, що віддає електрони, називають відновником.
Процес віддачі електронів атомами, молекулами, простими чи складними іонами, внаслідок якого збільшується ступінь окиснення елементів, називають окисненням. Умовно приймають, що у процесі окиснення відновник віддає електрони, а у процесі відновлення - окисник їх приєднує, при цьому будову частинок, природу хімічного зв'язку та механізм процесу не враховують.
Речовину, яка містить елемент, що приєднує електрони, називають окисником.
Процес приєднання електронів атомом, молекулою або іоном, який спричиняє зменшення ступеня окиснення елементів, називають відновленням. Наприклад, у реакції: Fe + 2 HCl = FeCl2 + H2 Ферум та Гідроген змінюють ступінь окиснення від 0 до +2 ферум і від +1 до 0 гідроген. Ферум є відновником, оскільки у реакції кожен атом Феруму віддає два електрони, внаслідок чого його ступінь окиснення збільшується - відбувається процес окиснення Феруму. Окисником у реакції є катіони гідрогену, які приєднують електрони, зменшують ступінь окиснення від + 1 до 0, внаслідок чого іони гідрогену відновлюються.
Електронні рівняння цих перетворень мають вигляд:
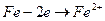
 процес окиснення відновника.
процес окиснення відновника.
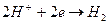 процес відновлення окисника.
процес відновлення окисника.
Процеси відновлення та окиснення елементів перебігають одночасно і загальне число електронів, відданих відновником, дорівнює загальному числу електронів, які приймає окисник.
2. Окисно-відновні властивості простих речовин та сполук елементів. Окисно-відновна активність простих речовин залежить від конфігурації валентних електронів їх атомів, тому її визначають за положенням елементів у періодичній системі.
У головних підгрупах елементів періодичної системи із збільшенням атомного номера елемента відновні властивості простих речовин зростають, а окиснювальні — зменшуються. Це зумовлено збільшенням числа енергетичних рівнів у елементів підгрупи і, відповідно, збільшенням їх атомних радіусів, внаслідок чого зовнішні електрони атомів утримуються слабше.
У межах періоду із збільшенням порядкового номера елемента зростає число зовнішніх електронів, енергетичний рівень стає більш стійким, тому атоми елементів легше приєднують електрони, ніж віддають. Відповідно відновні властивості простих речовин у межах періоду зменшуються, а окиснювальні — зростають і стають максимальними у галогенів, серед яких найбільш активним є фтор. Внаслідок окисно-відновних реакцій галогени відновлюються до відповідних галогенід-іонів:
2 Fe + ЗС12 = 2FeCl3.
Оскільки метали мають у зовнішньому енергетичному рівні від одного до трьох електронів, їх прості речовини можуть бути лише відновниками. Отже, прості речовини елементів IА, IIА груп, усіх побічних підгруп, лантаноїдів та актиноїдів виявляють лише відновні властивості. Внаслідок реакції вони окиснюються до відповідних катіонів. Тому метали називають елементами-відновниками:
Bi + 4HN03 = Bi(NO3)3 + NO + 2Н20.
Для неметалів характерним є процес приєднання електронів, тому їх називають елементами-окисниками. Однак лише фтор має виключно окиснювальні властивості, він лише приєднує електрони. Інші неметали можуть не лише приймати, але і віддавати електрони та проявляти окиснювально-відновну двоїстість. Як відновники, неметали окиснюються до сполук, в яких мають позитивні ступені окиснення:
0 +2
2С + O2 = 2СО,
0 +5 +3 +4
В + 3HNО3 = H3BO3 + 3NО2,
+4 0 +2 +1
MnO2 +H2 = MnO + H2O.
Однак відновні властивості неметалів проявляються слабше, ніж окиснювальні. Як окисники, неметали відновлюються до сполук, в яких проявляють негативні ступені окиснення.
Таким чином, залежно від положення елементів у періодичній системі їх окисно-відновні властивості змінюються від виражених відновних у лужних металів до окиснювальних у галогенів.
У елементів середніх груп періодичної системи мало виражені окиснювальні та відновні властивості, вони проявляють слабко виражену окиснювально-відновну двоїстість.
Оскільки електронегативність елементів характеризує неметалічні властивості їх простих речовин, за значенням електронегативності можна оцінювати окиснювально-відновні властивості простих речовин елементів. Елементи-окисники мають велике значення електронегативності: Ен = 3,5-4,0. Елементи-відновники мають електронегативність меншу за одиницю Ен<1. Елементи, які в однаковій мірі проявляють окиснювальні та відновні властивості, мають значення електронегативності Ен = 2, що відповідає поділу елементів на метали та неметали.
Катіони металів у вищому ступені окиснення мають лише окиснювальні властивості, оскільки атоми цих елементів уже віддали валентні електрони і тепер спроможні лише приймати їх. Найбільші окиснювальні властивості мають катіони малоактивних металів. Це катіони Cu2+, Ag+, Au3+, Pb4+, Sn4+, які відновлюються внаслідок реакції до атомів відповідних елементів або катіонів у нижчому ступені окиснення.
Катіони лужних і лужноземельних металів - слабкі окисники. У нижчому ступені окиснення катіони металів мають окиснювально-відновну двоїстість, з більш вираженими відновними властивостями. Так, катіони Fe2+, Cu+, Mn2+, Cr2+, Sn2+ є сильними відновниками, вони здатні віддавати електрони і утворювати катіони у вищому ступені окиснення.
Залежно від ступеня окиснення елементів, складні речовини проявляють відновні або окиснювальні властивості. Якщо елементи (метали або неметали) знаходяться у сполуці у вищому ступені окиснення, то сполука або іон має лише окиснювальні властивості та відновлюється внаслідок реакції до сполуки, яка містять елемент у нижчому ступені окиснення. Так, оксиди Mn2O7, N2O5, CrO3, Cl2O7, PbO2 є сильними окисниками. Аніони солей або кислот, які містять елемент (метал або неметал), у вищому ступені окиснення проявляють сильні окиснювальні властивості. Наприклад, сполуки, які містять SO42-, NO3-, Cr2O72-, MnO4- - іони є сильними окиснювачами, здатними окиснювати малоактивні метали та неметали:
Cu + 2H2SO4(k) = CuSO4 + SO2 + 2Н20,
As + 5HNO3 = H3AsO4 + 5NO2 + Н2O.
Якщо до складу сполук входять елементи, які знаходяться у проміжному ступені окиснення, то такі речовини проявляють окиснювально-відновну двоїстість. Пероксид водню H2O2, нітрит натрію NaNO2, сульфіт натрію Na2SO3, оксид мангану MnO2, оксид хрому(Ш) Cr2O3 у реакціях виявляють окиснювально-відновну двоїстість. Наприклад, H2O2 у реакції з KMnO4 є відновником, а при взаємодії з KI проявляє окиснювальні властивості:
5Н2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8Н2O,
2КІ + H2O2 = I2 + 2КOН.
Найважливіші окисники та відновники
| Відновники | Окиснена форма відновника |
| Метали | У кислому середовищі утворюють катіони:
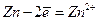 У нейтральному середовищі утворюють оксиди і гідроксиди:
У нейтральному середовищі утворюють оксиди і гідроксиди:

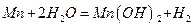 У лужному середовищі утворюють гідроксокомплекси:
У лужному середовищі утворюють гідроксокомплекси:
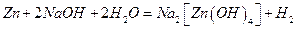
|
| Неметали з малим значенням електронегативності | 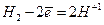
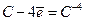 у формі у формі 
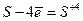 у формі у формі 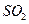 у надлишку кисню та у формі у надлишку кисню та у формі 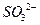 у лужному середовищі у лужному середовищі
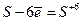 у формі у формі 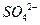 у кислому середовищі дією сильних окисників у кислому середовищі дією сильних окисників
|
| Катіони металів у нижчому ступені окиснення | Утворюють катіони у вищому ступені окиснення або входять до складу аніонів:

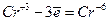 у формі
у формі 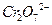 у кислому середовищі;
у формі CrO42- у лужному середовищі
Mn+2 - 2 е = Mn+4
у формі MnO2 у нейтральному середовищі
Mn+2 - 4 е → Mn+6
у формі MnO42- у лужному середовищі
Mn+2- 5e = Mn+7
у формі MnO4- у кислому середовищі у кислому середовищі;
у формі CrO42- у лужному середовищі
Mn+2 - 2 е = Mn+4
у формі MnO2 у нейтральному середовищі
Mn+2 - 4 е → Mn+6
у формі MnO42- у лужному середовищі
Mn+2- 5e = Mn+7
у формі MnO4- у кислому середовищі
|
| Аніони неметалів (аніони безкисневш кислот) | 2Br- -2e= Br2 S-2 - 2 е = S0 дією KMnO4, K2Cr2O7, H2SO4, O2 S-2 - 6 е = S+4 у формі SO2 у надлишку кисню S-2 - 8 е = S+6 у формі SO42- під дією сильних окисників HNO3, хлорна вода |
| Молекули та іони, які мають атом неметалу у проміжному ступені окиснення | S+4 - 2 е = S+6 у формі SO42- дією сильних і середньої сили окисників H2O2 - 2е = O2 + 2Н+ у кислому середовищі H2O2 окис- нюється до O2 N+3 -e = N+5 у кислому середовищі NO2- окиснюєіься до NO3- S2O32- + H2O - 2е= S + SO42- + 2Н+за недостачею сильних окисників хлорної та бромної води 2S2O32- - 2е = S4O62-у реакції із слабкими окисниками I2, FeCl3 |
| Окисники | Відновлена форма окисників |
| Неметали з великим значенням електронегативності | Приєднують електрони з утворенням відповідних аніонів: Cl2 + 2е= 2С1- O2 + 4е = 2O-2 у формі H2O у кислому середовищі, у формі OH- у лужному середовищі S + 2 с = S-2 у присутності сильних відновників |
| Катіони металів у вищому ступені окиснення | Приєднують електрони та утворюють катіони у нижчому ступені окиснення або атоми відповідних елементів: Fe+3 +e= Fe+2 Cu+2 + 2 е = Cu0 |
| Іон гідрогену H+ | 2Н+ + 2е = H2 у реакціях з металами, які розміщені в електрохімічному ряді напруг до водню |
| Іони та молекули, які містять елемент у вищому або високому ступені окиснення | Елемент приєднує електрони і понижує ступінь окиснення: Cr*4 + 35 = Crt3 у кислому середовищі у формі солі катіона Cr3+ Mn+7 + 5е = Mn+2 у кислому середовищі у формі солі катіона Mn2+ Mn+7 + 3е = Mn+4 у нейтральному середовищі у формі MnO2 Mn+7 + е = Mn+6 у сильно лужному середовищі у формі MnO42- S+6 + 2e = S+4 у формі SO2 у реакції концентрованої H2SO4 з неметалами та малоактивними металами Pb, Cu, Hg, Ag S+6 + 6e= S0 та S+6 + 8е = S-2 у реакції з активними металами N+5 + е = N+4 у формі NO2 у реакції концентрованої HNO3 з неметалами та малоактивними металами Cu, Hg, Ag N+5 + 3е = N+2 у формі NO при взаємодії розведеної HNO3 з малоактивними металами N+5 + 4е = N+1 у формі N2O при взаємодії розведеної HNO3 з активними металами N+5 + 8е = N-3 у формі NH4NO3 при взаємодії дуже розведеної HNO3 з активними металами при нагріванні |
| Іони та молекули, які містять елемент у проміжному ступені окиснення | H2O2 +2 е = 2ОН- H2O2 + 2Н+ + 2е = 2Н20 пероксид водню H2O2 відновлюється до гідроксид-іонів ОН- у лужному середовищі, до H2O у кислому середовищі N+3 + 5е = N+2 у формі NO при взаємодії нітритів у кислому середовищі |
3. Типи окисно-відновних реакцій. Розрізняють три основних типи окисно-відновних реакцій:
· міжмолекулярний,
· внутрішньомолекулярний,
· диспропорціонування (дисмутації або самоокиснення-самовідновлення).
Міжмолекулярними називають окисно-відновні реакції, в яких елементи, що змінюють ступінь окиснення, входять до складу різних молекул:
5NaN02+2KMn04+3H2S04=5NaN03+2MnS04+K2S04+3H20.
У наведеному рівнянні реакції змінюють ступінь окиснення Нітроген, що входить до складу нітриту натрію, та Манган, який міститься у молекулі перманганату калію. Елементи, що окиснюються та відновлюються, входять до складу різних молекул. До міжмолекулярних окиснювально-відновних реакцій також належать реакції між речовинами, які містять один елемент у різних ступенях окиснення. Після реакції цей елемент має однаковий ступінь окиснення:
2 H2 S + H2SO3 = 3S + 3Н20,
NaCl + NaClO + H2SO4 = Cl2 + Na2SO4 + H2O.
Окисно-відновні реакції, внаслідок яких змінюють ступінь окиснення два різних елементи, що входять до складу однієї молекули, називають внутрішньомолекулярними реакціями. Реакції термічного розкладу сполук є внутрішньомолекулярними окисно-відновними реакціями:
(N H4)2Cr207 = N2+ Cr2O3 + 4Н20.
У наведеному рівнянні реакції змінюють ступінь окиснення атоми двох елементів, що входять до складу однієї молекули: відновлюється Хром, який зменшує ступінь окиснення від +6 до +3, і окиснюється Нітроген, який збільшує ступінь окиснення від -3 до 0.
До внутрішньомолекулярних окиснювально-відновних реакцій належать також реакції розкладу речовин, які містять атоми одного елемента у різних ступенях окиснення. Після реакції утворюється сполука, у якій цей елемент має однаковий ступінь окиснення:
NH4NO2 = N2 + 2Н20,
NH4NO3 = N2O + 2Н20.
Реакціями диспропорціонування (дисмутації) називають окисно-відновні реакції, внаслідок яких одночасно збільшується і зменшується ступінь окиснення одного елемента.Наприклад, внаслідок розкладу пероксиду водню, атоми Оксигену одночасно збільшують ступінь окиснення від -1 до 0 (окиснюються) та зменшують його від -1 до -2 (відновлюються):
2Н2О2 = 2Н2О + O2.
Уданій реакції окисником і відновником є Оксиген, який входить до складу молекули H2O2 у ступені окиснення -1. Подібні реакції можуть відбуватися в тому випадку, коли речовина містить елемент у проміжному ступені окиснення, тоді його атоми можуть одночасно відновлюватися та окиснюватися.
0 -1 +1
Br2 + 2NaOH = NaBr + NaBrO + H2O,
+5 -1 +7
4NaClO3 = NaCl + 3NaC1О4,
+6 +7 +4
3 K2MnO4 + 2Н2О = 2KMnО4 + MnO2 + 4КОН
4. Фактори, що впливають на перебіг окисно-відновних реакцій. Окисно-відновні реакції відбуваються лише за певних умов:
· кислотності середовища,
· температурі,
· концентрації реагуючих речовин,
· наявності каталізатора.
Окисно-відновні реакції здійснюються у різному середовищі:
· кислому (надлишок Н+-іонів),
· лужному (надлишок OH-- іонів)
· нейтральному (водному).
Вплив кислотності середовища у деяких випадках окисно-відновної взаємодії має настільки велике значення, що визначає напрямок перебігу реакції або можливість її здійснення. Наприклад, реакція:
I2 + H2O ↔ HI + HIO
у лужному середовищі перебігає праворуч, а у кислому - ліворуч. Сполуки хрому(VІ) проявляють окиснювальні властивості у кислому середовищі, а сполуки хрому(ІІІ) - відновні влативості у лужному середовищі. Так, хромат калію у нейтральному середовищі не окиснює нітрит натрію навіть при кип'ятінні. При підкисленні цього розчину реакція відбувається при кімнатній температурі:
3NaN02 + K2Cr2O7 + 4H2S04 = 3NaN03 + Cr2(SO4)3 + K2SO4 + 4Н20.
Залежно від кислотності середовища змінюються продукти реакції, тобто процес окиснення або відновлення буде протікати по-різному. Наприклад, перманганат-іон у кислому середовищі відновлюється до катіона Mn2+, у нейтральному до MnO2, а у лужному середовищі реакція відбувається з утворенням манганат-іона MnO42-.
Для створення кислого середовища використовують розведену сульфатну кислоту, оскільки нітратна кислота будь-якої концентрації є сильним окисником, а хлоридна - має відновні властивості. Лужне середовище створюють за допомогою розчинів гідроксиду калію або натрію.
Аналогічно на перебіг окисно-відновних реакцій впливає температура: деякі реакції відбуваються лише при нагріванні або залежно від температури утворюються різні продукти взаємодії. Наприклад, при кімнатній температурі концентрована нітратна кислота не взаємодіє з залізом, хромом, алюмінієм, а концентрована сульфатна із свинцем. При нагріванні реакційного середовища указані реакції перебігають бурхливо. При кімнатній температурі у лужному середовищі галогени диспропорціонують з утворенням сполук із ступенем окиснення -1 та +1:
0 -1 +1
Cl2 + 2NaOH = NaCl + NaClO + H2O.
При кип'ятінні реакційної суміші галогени окиснюються сильніше, утворюючи сполуки із ступенем окиснення -1 та +5:
0 -1 +5
3С12 + 6КОН = 5 KCl + KClO3 + 3Н2О.
Вплив концентрації реагуючих речовин на окисно-відновний процес проявляється при взаємодії кислот з металами та неметалами. Так, розведена сульфатна кислота окиснює іоном гідрогену усі метали, розміщені у електрохімічному ряді напруг до водню:
Zn + H2SO4 = ZnSO4 + Н,
та не взаємодіє з металами, які знаходяться у ряді напруг після водню. Концентрована сульфатна кислота окиснює сульфат-іоном малоактивні метали - мідь, ртуть, срібло, розміщені у ряді напруг після водню:
Cu + 2H,SО4 = CuSO4 + SO2 + 2Н2О.
Неметали легше окиснюються концентрованою нітратною кислотою:
S + 6HNО3 = H2SO4 + 6NО2 + 2Н2О,
P + 5HNО3 = H3PO4 + 5NО2 + H2O.
При взаємодії нітратної кислоти з металами, залежно від її концентрації, утворюються різні продукти відновлення нітрат-іона:
3Cu + 8HNО3 = 3Cu(NО3)2 + 2NО + 4Н2О,
Cu + 4HNО3 = Cu(NO3)2 + 2NО2 + 2Н2О.
При взаємодії нітратної кислоти з активними металами продуктами відновлення нітрат-іона можуть бути N2, N2O, NH4NO3.
Вплив каталізатора на окисно-відновну взаємодію розглянемо на прикладі реакції диспропорціонування пероксиду водню та взаємодії алюмінію з йодом. Без каталізатора реакція розкладу пероксиду водню відбувається повільно. При наявності каталізатора, наприклад, оксида мангану(ІV) MnO2 реакція відбувається миттєво:
MnO2
2Н2О2 = 2Н2О + O2.
На взаємодію алюмінію з йодом впливає додавання невеликої кількості води. Без каталізатора реакція практично не перебігає:
H2O
2А1 + 3І2 = 2 AlI3.
5. Складання рівнянь окисно-відновних реакцій. Для складання рівнянь окиснювально-відновних реакцій необхідно знати емпіричні формули речовин, які вступають в реакцію, та продуктів реакції. Продукти реакції визначають експериментально або на основі властивостей елементів.
Окисно-відновна реакція можлива лише у тому випадку, коли реакційне середовище має окисник і відновник, тобто речовини, до складу яких входять елементи, здатні зменшувати або збільшувати ступінь окиснення.
Щоб вірно записати рівняння окиснювально-відновної реакції, слід дотриматися закону збереження маси речовин. Тобто у лівій та правій частинах рівняння реакції повинно знаходитися однакове число атомів однотипових елементів. Також необхідно дотриматися закону збереження зарядів: у іонному рівнянні реакції сумарний заряд іонів лівої частини рівняння реакції повинен дорівнювати сумарному заряду іонів - продуктів реакції. При цьому сума зарядів іонів кожної частини рівняння може мати позитивне, негативне значення або дорівнювати нулю.
У рівнянні реакції першим записують відновник, а потім окисник. Останньою записують речовину, яка утворює реакційне середовище. Праворуч у рівнянні реакції спочатку записують продукт окиснення відновника, потім продукт відновлення окисника. Останніми записують інші продукти, які утворилися внаслідок реакції.
Для визначення коефіцієнтів у рівнянні окисно-відновної реакції використовують два методи:
· метод електронного балансу;
· електронно-іонний метод (метод напівреакцій).
Метод електронного балансу є універсальним, його застосовують для знаходження коефіцієнтів у рівняннях окисно-відновних реакцій, які перебігають у будь-якому агрегатному стані - твердому, газоподібному або у розчині. Цей метод базується на врахуванні зміни ступенів окиснення елементів вихідних речовин і продуктів реакції.
Розглянемо використання методу електронного балансу на прикладі окиснення діоксиду мангану хлоратом калію у присутності гідроксиду калію у випадку, коли суміш твердих речовин взаємодіє при підвищеній температурі у розплаві. Спочатку записують схему реакції, в якій вказують вихідні речовини та продукти взаємодії. Потім обчислюють ступені окиснення усіх елементів і знаходять серед них ті, які внаслідок реакції його змінили. Зазначають ці елементи, вказуючи їх ступінь окиснення до та після реакції. Визначають окисник та відновник:
+4 +5 +6 -1
MnO2 + KClO3 + KOH → K2MnO4 + KCl + H2O.
Внаслідок реакції Манган і Хлор змінили ступінь окиснення. Атом Мангану віддав два електрони, за рахунок чого збільшив свій ступінь окиснення від +4 до +6, тому оксид мангану(ІV) - відновник, який окиснюється до манганату калію K2MnO4. Атом Хлору приєднав шість електронів, зменшив ступінь окиснення від +5 до -1, тому хлорат калію KClO3 - окисник, який відновився до хлориду калію.
Записують електронні рівняння (схеми), які відображають процеси окиснення та відновлення елементів:
Mn+4 - 2e = Mn+6 | 3
Cl+5 + 6е = Cl-1 | 1
Оскільки число електронів, які віддає відновник, повинно дорівнювати числу електронів, які приєднує окисник, знаходять найпростіші співвідношення числа молів окисника та відновника, які задовольняють цій умові. У наведеному прикладі атом Хлору приймає шість електронів, які повинні віддати 3 атоми Мангану. Тому праворуч від електронних рівнянь записують співмножники 3 і 1, за допомогою яких урівнюють число електронів, відданих Манганом і приєднаних Хлором. Співмножники 3 і 1 є стехіометричними коефіцієнтами для відновника та окисника у рівнянні окиснювально- відновної реакції:
3MnO2 + KClO3 + KOH → 3K2MnO4 + KCl + H2O.
Потім знаходять коефіцієнти для інших речовин, які приймають участь у реакції. Спочатку урівнюють число усіх катіонів, крім катіона гідрогену H+, потім - число аніонів. Щоб урівняти число катіонів калію, необхідно до реакції взяти шість молекул КОН. Відповідно шість іонів гідрогену, які містять молекули гідроксиду калію, утворюють три молекули води:
3Mn02 + KClO3 + 6КОН = 3K2MnO4 + KCl + 3Н2О.
Для перевірки знайдених коефіцієнтів досить обчислити число атомів Оксигену у лівій та правій частинах рівняння. Ліворуч речовини містять 6 + 3 + 6 = 15 атомів Оксигену, праворуч 12 + 3 = 15 атомів Оксигену. Переписують рівняння окисно-відновної реакції в іонній формі:
3MnO2 + K+ + ClO3- + 6К+ + 6ОН- = 6К+ + 3MnО42- + K+ + Cl- + 3Н2О.
Після скорочення однакових іонів у лівій та правій частинах рівняння, одержують скорочене іонне рівняння окиснювально-віднов- ного процесу:
3MnO2 + ClO3- + 6ОН- = 3MnО42- + Cl- + 3Н2О.
Іонно-електронний метод (метод напівреакцій) використовують для складання рівнянь окисно-відновних реакцій, які перебігають у розчинах електролітів. Згідно з іонно-електронним методом враховують взаємодію іонів, які реально існують у розчині. За цим методом процеси окиснення та відновлення речовин розглядають окремо і записують їх у вигляді іонних напівреакцій. Прості речовини, слабкі електроліти, малорозчинні та газоподібні сполуки записують у рівнянні у вигляді молекул. Потім рівняння напівреакцій підсумовують у загальне іонне рівняння. При складанні рівнянь окисно-відновних реакцій за іонно-електронним методом слід дотриматися певних правил.
Розглянемо їх на прикладі складання рівняння взаємодії сірководню H2S з дихроматом калію K2Cr2O7 у кислому середовищі. Експериментально встановлено, що внаслідок взаємодії оранжевий розчин дихромату калію стає зеленим та утворюється осад. Така зміна реакційного середовища свідчить, що дихромат-іон відновився до катіона хрому(ІІІ), а сірководень окиснив ся до сірки, яка утворила осад.
При визначенні коефіцієнтів у рівнянні реакції за іонно-електронним методом послідовність дій така ж, як і за методом електронного балансу. Спочатку складають схему реакції, у якій вказують вихідні речовини та продукти взаємодії, обчислюють ступені окиснення всіх елементів і визначають, які з них внаслідок реакції змінили ступінь окиснення:
-2 +6 0 +3
H2 S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 +...
Три крапки у схемі реакції свідчать про те, що внаслідок взаємодії утворюються ще інші продукти реакції, які не приймають участь у окисно-відновному процесі.
У даній реакції відновником є сірководень, атом Сульфуру якого віддає два електрони і збільшує ступінь окиснення від -2 до 0, а окисником - дихромат калію, атом Хрому якого приймає три електрони і зменшує ступінь окиснення від +6 до +3. Складають іонну схему реакції, в якій записують лише ті іони і молекули, які приймають участь у окисно-відновному процесі:
H2S + Cr2O72- + H+ → S + Cr3+ + H2O.
Дотримуючись закону збереження маси речовин, складають рівняння напівреакцій окиснення відновника та відновлення окисника таким чином, щоб число атомів кожного елемента у лівій і правій частинах рівняння було однаковим. Тобто, за допомогою коефіцієнтів урівнюють число атомів усіх, крім Оксигену, елементів у лівій і правій частинах рівняння реакції. Потім урівнюють число атомів Оксигену у лівій та правій частинах напівреакції. Якщо реакція перебігає у кислому середовищі, то надлишкові атоми Оксигену зв'язують іонами гідрогену. До тієї частини напівреакції, яка містить більше атомів Оксигену, додають катіони гідрогену. На кожний надлишковий атом Оксигену додають два іони гідрогену, а у протилежну частину рівняння реакції записують відповідну кількість утворених молекул H2O:
H2S → S0 + 2Н+,
Cr2O72- + 14Н+ → 2Cr3+ + 7Н2О.
Дотримуючись закону електронейтральності, урівнюють сумарний заряд іонів лівої та правої частин напівреакції додаванням чи відніманням відповідного числа електронів у лівій частині напівреакції. Слід зазначити, що у деяких підручниках електрони записують у ту частину напівреакції, де відбувається процес відновлення окисника. Однак автори дотримуються таких правил складання рівнянь окиснювально-відновних реакцій, які використовують при наступному вивченні даної теми у курсах аналітичної, органічної та фізичної хімії. Сумарний заряд іонів кожної частини напівреакції обчислюють як алгебраїчну суму їх зарядів.
У напівреакції окиснення сірководню вихідна речовина електронейіральна, тому її заряд дорівнює нулю. Продукти взаємодії у цій напівреакції мають два позитивних заряди 2+, зумовлені наявністю іонів гідрогену 2Н+. Щоб дотриматися умови збереження зарядів, слід у ліву частину записати два елекрони із знаком мінус. Потім у рівнянні записують оборотні стрілки, оскільки окисно-відновний процес є термодинамічною рівновагою:
- 2е + H2S ↔S + 2Н+.
У напівреакції відновлення дихромат-іона вихідні іони мають дванадцять позитивних зарядів 12+, а продукти реакції - шість позитивних зарядів 6+, тому ліворуч у рівняння напівреакції додають шість електронів:
+ 6е + Cr2O72- + 14Н+ ↔ 2Cr3+ + 7Н20.
Для складання загального іонного рівняння реакції знаходять такі співвідношення молекул окисника і відновника, щоб число відданих відновником електронів дорівнювало числу електронів, прийнятих окисником. Для цього знаходять найменше кратне для числа відданих і прийнятих електронів, та визначають відповідні співмножники, на які у рівняннях напівреакцій пере- множають коефіцієнти біля молекул та іонів. Потім записують іонне рівняння, підсумовуючи іони і молекули лівої та правої частин напівреакцій:
- 2е + H2S ↔S + 2Н+ | 3
+ 6е + Cr2O72- + 14Н+ ↔ 2Cr3+ + 7Н2О | 1
____________________________________
3H2S + Cr2O72- + 14Н+ → 3S + 2Cr3+ + 6Н+ + 7Н20
Скорочують однакові іони і молекули. У даному випадку ліву та праву частини рівняння скорочують на шість H+ і одержують скорочене іонне рівняння:
3H2S + Cr2O72- + 8H+ → 3S + 2Cr3+ + 7Н2О.
За Оксигеном перевіряють вірність складеного рівняння: число атомів Оксигену у лівій та правій частинах рівняння дорівнює 7. Заряд іонів правої частини рівняння дорівнює (2-) + (8+) = 6+, відповідно лівої частини 2(3+) = 6+.
На основі іонного записують молекулярне рівняння реакції таким чином: для кожного катіону підбирають аніон, який знаходиться у розчині, а для кожного аніона - відповідний катіон. Для указаних іонів дотримуються закону збереження маси, тобто їх число у лівій та правій частинах рівняння повинно бути однаковим:
3H2S + Cr2O72- + 8Н+ ↔ 3S + 2Cr3+ + 7H2О
2K+ + 4SО42- ↔ 4SО42- + 2K+
_____________________________________________________________________________________
3H2S + K2Cr2O7 + 4H2SО4 → 3S + Cr2(SO4)3 + K2SO4 + 7H20
Якщо окисно-відновна реакція відбувається у лужному або нейтральному середовищах, то надлишкові атоми Оксигену у лівій або правій частинах напівреакції зв'язують молекулами води, додаючи на кожний надлишковий атом Оксигену молекулу H2O, а у протилежну частину напівреакції записують вдвічі більше гідроксид-іонів ОН-. Наприклад, при взаємодії діоксиду мангану з бромом у лужному середовищі забарвлення розчину із оранжевого стає зеленим і зникає темно-коричневий осад. Це свідчить про відновлення брому (оранжеве забарвлення) до бромід-іонів (безбарвний розчин) і про утворення сполуки манганат-іона, яка зумовлює появу зеленого забарвлення розчину.
Записують схему окисно-відновного процесу в молекулярному та іонному вигляді:
+4 0 +6 -1
MnO2 + Br2 + KOH → K2MnO4 + KBr + H2O,
MnO2 + Br2 + OH- → MnO42- + 2Br- + Н2О.
У даній реакції змінюють ступені окиснення Манган від +4 до +6 та Бром від 0 до -1. Тому відновником є MnO2, а окисником - Br2.
Записують рівняння напівреакцій окиснення відновника та відновлення окисника:
- 2e + MnO2 + 4ОН- ↔ MnO42- + 2Н2О | 1
+2е + Br2 ↔ 2Вг- | 1
________________________________________
MnO2 + Br2 + 4ОН- → MnO42- + 2Br- + 2Н2О
У першій напівреакції оксид мангану(ІV) MnO2 містить лише два атоми Оксигену, а продукт реакції MnO42- - чотири. Тому у праву частину напівреакції додають дві молекули H2O, а ліворуч записують чотири гідроксид-іони ОН-. На основі іонного молекулярне рівняння реакції записують так:
MnO2 + Br2+ 4ОН- = MnO42- + 2Br- + 2Н2О
4 K+ = 2 K+ + 2К+
_______________________________________________________
MnO2 + Br2 + 4КОН = K2MnO4+ 2KBr + 2Н2О
Якщо окисно-відновна реакція відбувається у нейтральному середовищі, наприклад, при взаємодії сульфіту натрію Na2SО3 з перманганатом калію KMnO4, надлишкові атоми Оксигену також зв'язують молекулами H2O, а у протилежну частину напівреакції записують вдвічі більше гідроксид-іонів:
+4 +7 +6 +4
Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
- 2е + SO32- + 2OH- ↔ SO42- + Н2О |3
+ 3е + MnO4- + 2Н2О ↔ MnO2 + 4OH- | 2
____________________________________
3SO32- + 2MnO4- + 6OH- + 4Н2О → 3SO42- + 2MnO2 + 3Н2О + 8OH-
Після скорочення молекул H2O та ОН- іонів у лівій та правій частинах рівняння реакції, скорочене іонне рівняння окисно-відновного процесу має вигляд:
3SO32- + 2MnO4- + Н2О ↔ 3SO42- + 2MnO2 + 2OH-
Ha основі іонного записують молекулярне рівняння реакції:
3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 6308; Нарушение авторских прав?; Мы поможем в написании вашей работы!