
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стан комплексних сполук у розчині
|
|
|
|
Номенклатура комплексних сполук.
Основні положення сучасної номенклатури комплексних сполук можна звести до таких правил.
1. У назві будь яких типів комплексних сполук спочатку називають аніон, а потім у родовому відмінку катіон:
а) назву катіонних комплексів починають з характеристики зовнішньої сфери комплексної сполуки;
б) для аніонних комплексів після характеристики складу внутрішньої сфери вказують назву іонів зовнішньої сфери.
2. Для всіх типів комплексних сполук (катіонних, аніонних, молекулярних) подається повна характеристика внутрішньої сфери. В першу чергу вказуються у алфавітному порядку назви аніонів-лігандів, додаючи до них закінчення – “о” (F--фторо, Cl--хлоро-, CN--ціано, OH--гідроксо, SO32--сульфіто, SCN--тіоціанато, SO42--сульфато, C2O42--оксалато, P2O74--дифосфато тощо). Число лігандів позначається грецькими числівниковими префіксами: 1-моно, 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса та ін. (числівник моно- як правило опускається).
Далі називають ліганди – нейтральні молекули. У першу чергу аміак та його похідні, воду і т.д. При цьому користуються такими поширеними термінами: NН3 – амін, Н2О – аква, NО – нітрозил, СО – карбоніл. Інші ліганди зберігають свої звичайні назви.
3. Останнім називають центральний атом (комплексоутворювач):
а) якщо центральний атом входить до складу катіона або молекули, то використовують українську назву цього елемента і в дужках після нього римськими цифрами зазначають ступінь його окислення;
б) якщо центральний атом входить до складу аніона, використовують латинську назву елемента, додаючи закінчення – “ат”, а в дужках після нього римськими цифрами зазначають ступінь його окислення;
в) у випадку молекулярних комплексів вказують українську назву комплексоутворювача, а заряд його не зазначається.
Нижче подано формули та назви комплексних сполук різної хімічної природи.
З комплексним катіоном:
[Ag(NH3)2](NO3)2 – нітрат диамінсрібла (І);
[Co(H2O)6]Br3 – бромід гексааквакобальту (ІІІ);
[Cu(NH3)4](OH)2 – гідроксид тетрамінміді (ІІ);
[Ni(NH3)6]Cl2 – хлорид гексаміннікелю (ІІ);
[Ni(NH3)6]Cl3 – хлорид гексаміннікелю (ІІІ).
З комплексним аніоном:
K3[Fe(CN)6] – гексаціаноферат (ІІІ) калію;
K4[Fe(CN)6] – гексаціаноферат (ІІ) калію;
H2[SiF6] – гексафторосілікат (ІV) водню;
Na2[Zn(OH)4] – тетрагідроксоцинкат (ІІ) натрію.
Молекулярний комплекс:
[Pt(NH3)2Cl2] – дихлородиамінплатина;
[Cr(NH3)3Br3] – трибромотриамінхром;
[Co(H2O)4(NO2)2] – динітротетрааквакобальт.
Більшість координаційних сполук у розчинах виявляють властивості сильних електролітів внаслідок дисоціації їх на комплексні іони та іони, що складають зовнішню сферу. Така дисоціація комплексних сполук має назву первинної. Наприклад:
[Сu(NН3)4]SO4 Û [Сu(NН3)4]2+ + SO42-;
K3[Fe(CN)6] Û 3K+ + [Fe(CN)6]3-.
За допомогою характерних хімічних реакцій можна встановити наявність у розчині простих і комплексних іонів.
1). Так, у першому випадку, якщо подіяти на розчин [Cu(NН3)4]SO4 розчином солі барію, утворюється осад ВаSO4:
[Сu(NН3)4]SO4 + Ba(NO3)2 → [Сu(NН3)4](NO3)2 + BaSO4↓,
що підтверджує наявність у розчині іонів SO42-. Це рівняння може бути записано у іонному вигляді:
[Сu(NН3)4]2+ + SO42- + Ba2+ + 2NO3- → [Сu(NН3)4]2+ + 2NO3- + BaSO4↓
або скорочене іонне рівняння:
SO42- + Ва2+ → ВаSO4↓.
Якщо на цей же розчин подіяти лугом, осад Сu(ОН2) не утворюється, оскільки іони Сu2+ знаходяться у складі комплексних катіонів.
2). У розчині К3[Fе(СN)6] можна встановити наявність комплексних аніонів при дії солей заліза (ІІ). Утворюється специфічний осад турнбулевої синьки:
2K3[Fe(CN)6] + 3FeSO4 → Fe3[Fe(CN)6]2↓ + 3K2SO4.
Повне іонне рівняння цієї реакції:
6K+ + 2[Fe(CN)6]3- + 3Fe2+ + 3SO42- → Fe3[Fe(CN)6]2↓ + 6K+ + +3SO42-
або скорочене:
2[Fe(CN)6]3- + 3Fe2+ → Fe3[Fe(CN)6]2↓.
Луг у цьому випадку не осаджує Fе(ОН)3, тому що в розчині практично відсутні іони Fе3+.
Однак, використовуючи особливо чутливі прийоми, можна встановити наявність у розчинах невеликої кількості вільних іонів-комплексоутворювачів. Ці факти свідчать про вторинну дисоціацію комплексних іонів на складові частини.
Дисоціація комплексних іонів відбувається в незначній мірі (ступені) подібно слабким електролітам і підкоряється закону діючих мас. Кількісно охарактеризувати цей процес можна за допомогою константи дисоціації комплексного іона. Для рівноваги:
[Zn(NH3)4]2+ Û Zn2+ + 4NH3

Константа рівноваги процесу дисоціації комплексних іонів одержала назву константи нестійкості βн. Замість значень констант нестійкості все частіше використовують їх обернені величини, що мають назву констант стійкості βс. Ці дві константи зв’язані між собою простим співвідношенням:
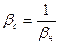
Для наведеної рівноваги:

Вторинна дисоціація комплексних іонів відбувається ступінчасто:
[Zn(NH3)4]2+ Û [Zn(NH3)3]2+ + NH3 І ст.
[Zn(NH3)3]2+ Û [Zn(NH3)2]2+ + NH3 ІІ ст.
[Zn(NH3)2]2+ Û [Zn(NH3)]2+ + NH3 ІІІ ст.
[Zn(NH3)]2+ Û [Zn2+] + NH3 ІV ст.
Процеси вторинної дисоціації визначаються стійкістю комплексних іонів. Чим стійкішим є комплексний іон, тим більше рівновага дисоціації зміщується вліво.
Кожний ступінь дисоціації комплексного іона кількісно характеризується константою рівноваги, яка одержала назву ступінчастої константи стійкості. Для [Zn(NH3)4]2+ таких констант буде чотири:

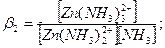


де β1 < β2 < β3 < β4 – перша молекула аміаку відщеплюється від комплексного іону найлегше, друга – важче, остання – найважче.
Добуток ступінчастих констант стійкості приводить до виразу загальної константи стійкості комплексного іона:

Також ступінчасто дисоціюють і комплексні аніони:

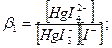
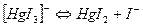



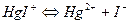

Значення констант стійкості (нестійкості) наводяться в довідниках з хімії; за їх величинами можна кількісно порівнювати різні комплексні сполуки, передбачати перебіг хімічних реакцій, в яких відбувається комплексоутворення. Із математичного виразу константи стійкості випливає висновок: чим менш рівноважні концентрації продуктів дисоціації комплексних іонів, тим більше значення константи стійкості (рβс) і тим стійкіший комплексний іон.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 936; Нарушение авторских прав?; Мы поможем в написании вашей работы!