
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механізми утворення ковалентного звязку
Ковалентний зв'язок - двоелектронний, двохцентровий. На основі уявлень про механізм утворення хімічного зв'язку Гайтлером і Лондоном було розроблено теорію хімічного зв'язку - Метод валентних зв'язків.
ЛЕКЦІЯ ІІІ. ХІМІЧНИЙ ЗВ'ЯЗОК. ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ.
План:
1. Типи хімічного зв'язку. Механізм утворення ковалентного зв'язку.
2. Властивості ковалентного зв'язку. Гібридизація атомних орбіталей. Полярні і неполярні молекули.
3. Теорії хімічного звязку. Метод валентних зв'язків (ВЗ) і метод молекулярних орбіталей (МО).
4. Іонний звязок. Водневий звя'зок.
5. Основні параметри молекул.
І. При взаємодії атомів, іонів чи їх груп між ними може виникати хімічний звя'зок, який приводить до утворення стійкої багатоатомної системи – молекули, молекулярного іону, кристалу, сольвату, комплексної сполуки. Умовою утворення хімічного зв'язку є зменшення потенціальної енергії системи взаємодіючих атомів. Система – сукупність взаємодіючих часточок – атомів, атомних ядер, електронів.
Основні типи хімічного зв'язку:
· іонний,
· ковалентний,
· водневий.
Мірою міцності зв'язку є енергія розриву, яка завжди позитивна, в іншому випадку хімічний зв'язок розривався б самостійно з виділенням енергії.
Основні положення:
1. Ковалентний хімічний звязок утворюється двома електронами з протилежно направленими спинами, електронна пара належить двом атомам.
2. Ковалентний звязок тим міцніше, чим в більшій мірі перекриваються електронні хмари.
Ковалентність - число спільних електронних пар, які зв¢язують атом даного елемента з іншими атомами.
Наприклад: ковалентність азоту в N2 i NH3=3
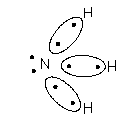

Ковалентність кисню в H2O i CO2 = 2, ковалентність вуглецю в СН4 = 4.
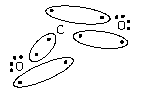
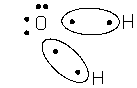
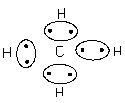
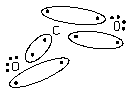
Спільна електронна пара може утворюватися:
· за рахунок неспарених електронів незбудженного атома (N2, NH3 i ін.);
· за рахунок неспарених електронів внаслідок збудження атому (CO2, CH4 і ін., умова, якщо енергія збудження менше енергії зв¢язків, які утворюються, оскільки в іншому випадку процес енергетично не можливий).
· за донорно-акцепторним механізмом.
Наприклад: іон амонію NH4
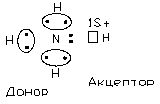
Зв’язок утворюється за рахунок неподіленої електронної пари донора (N) і вільної орбіталі акцептора (H), при чому всі звязки N-H в усіх відношеннях рівнозначні.
Властивості ковалентного звязку:
1. Кількість ковалентних звязків, які може утворювати даний атом обмежена і називється насиченістю ковалентного звязку. Воно визначається загальним числом валентних орбіталей, використання яких є нергетично вигідним. Як правило це s- і p-орбіталі зовнішнього шару і d-орбіталі передзовнішнього.
2. Направленість, тобто характер взаємовідносин області перекриття електронних хмар і ядер атомів.
Розрізняють:
1) s - зв'язок, якщо область перекриття електронних хмар знаходиться вздовж лінії, що зєднує ядра взаємодіючих атомів.
Він може утворюватися за рахунок перекриття:
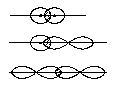 --s-s - електронних хмар, наприклад Н2
--s-s - електронних хмар, наприклад Н2
--s-p - елктронних хмар, наприклад НF
--p-p - електронних хмар, наприклад F2
2) p - звязок, при взаємодії р-електронних хмар утворюються 2 області перекриття, які розташовані перпендикулярно лінії, що зєднують ядра атомів.
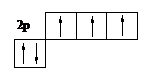
Наприклад молекула N2.
|
 Кожний атом азоту -
Кожний атом азоту -
| |||
 | |||
|
|  |
За характером перекриття електроних хмар тільки рх – рх дає s-звязок, 2 інших звязки - p, таким чином в молекулі N2: один s-звязок і 2 p-звязки.
Більшість багатоатомних молекул мають не площинну конфігурацію, а просторову, тобто потрібно ввести поняття валентного кута, кута між звязками. Але теоретично передбачений валентний кут не завжди відповідає експерементально визначеному. Так, в молекулі води, яка має кутову будову кут дорівнює 900, в молекулі аміаку, яка має форму піраміди, кут дорівнює 900. В реальних молекулах ці кути дорівнюють 104,50 і 107,30, відповідно. Чим це пояснюється?
n При утворенні молекул форми і взаємне розташування атомних електронних хмар змінюються порівняно з вільними атомами таким чином, щоб утворилась стійка конфігурація з мінімальною потенціальною енергією.
n В межах метода ВЗ така перестройка електронної структури атома розглядається на основі уявлень про гібридизацію атомних орбіталей.
Гібридизація – це зміна форми електронних хмар, завдяки чому досягається їх повне перекриття, тобто утворення більш міцного хімічного звязку. Якщо енергія на деформацію АО менше енергії хімічного звязку, то така гібридизація приводить до збільшення стійкості молекул
Розрізняють:
а)  -
-
б)  -
-
в) 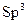
·
|
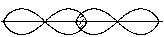
|
|
|
| ||||||
| ||||||||
3
Замість цього утворюється 2 гібридні орбіталі берилія, тому процес називається Sp-гібридизацією
|
| ||||||
| |||||||
| |||||||
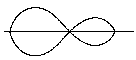
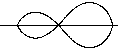
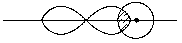
· Наприклад, BF3 - 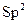 -гібридизація, так як в гібридизації приймають участь 1s і 2p орбіталі, в результаті чого утворюються 3 рівноцінні гібридні АО.
-гібридизація, так як в гібридизації приймають участь 1s і 2p орбіталі, в результаті чого утворюються 3 рівноцінні гібридні АО.
· Наприклад, CH4 - 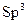 -гібридизація, приймають участь 1s і 3p орбіталі.
-гібридизація, приймають участь 1s і 3p орбіталі.
В молекулі NH3 – Sp-гібридизація АО центрального атома. Найбільша відмінність кута між звязками 109.5 градусів пояснюється асиметрією в розподілі електронних хмар навколо ядра атома азоту: з 4 електронних пар - 3 приймають участь у створенні звязку N—H, а одна – залишається неподіленою.
Неполярний і полярний ковалентний звязок.
а) неполярний, якщо двохатомна молекула складається з атомів одного елементу (H2, N2, Cl2), або гомеополярний;
б) полярний або гетерополярний, якщо молекулу утворюють атоми різних хімічних елементів, виникає асиметрія в розподіленні заряда.
n Для оцінки здатності атома даного елемента відтягувати до себе спільну електронну пару, використовують величину електронегативності. Електронегативность закономірно змінюється в залежності від положення елемента в Періодичній системі. Чим більш типовим металом є елемент, тим нижче його електронегативність, і електронегативність вище, чим більш типовим є неметал.
n Зміщення спільної електронної хмари в бік більш електронегативного атома при утворенні ковалентного звязку приводить до того, що один атом отримує надлишковий негативний, інший - позитивний заряд:
+σ>С=О-σ
Ці заряди мають назву ефективні заряди атомів у молекулі. Кількістною мірою полярності молекули є дипольний момент.
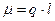
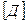

Дипольний момент вважають направленим від позитивного кінця диполя до негативного. Молекули також можуть бути неполярними при симетричному розподілі зарядів і 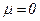 і полярними, коли
і полярними, коли 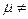 0. Оскільки
0. Оскільки 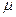 - величина векторна, то слід знайти векторну суму дипольних моментів молекули.
- величина векторна, то слід знайти векторну суму дипольних моментів молекули.
|
|
Дата добавления: 2014-11-16; Просмотров: 3159; Нарушение авторских прав?; Мы поможем в написании вашей работы!