
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекція ІІ. Будова атома. Періодичний закон та Періодична система хімічних елементів
|
|
|
|
Солі
Солі - це продукти заміщення атомів водню в молекулі кислоти на атоми металу або гідроксильної групи в молекулі основи на кислотний залишок.
Солі бувають:
· середні (нормальні),
· кислі,
· основні.
Середні солі - це продукти повного заміщення атомів водню в молекулі кислоти на атоми металу чи гідроксильних груп основного гідроксиду кислотним залишком, наприклад, CuSO4, Al(NO3)3:
H2SO4 + Cu(OH)2 ®CuSO4 + 2H2O,
Al(OH)3 + 3HNO3 ®Al(NO3)3 + 3H2O.
Кислі солі - це продукти неповного заміщення атомів водню в молекулі кислоти атомами металу. Кислі солі можуть бути утворені тільки багатоосновними кислотами, які були взяті у надлишку, наприклад, Ca(HCO3)2, Cu(HSO4)2, MgHPO4:
NaOH + H3PO4 ®NaH2PO4 + H2O,
Cu(OH)2 + 2H2SO4 ®Cu(HSO4)2 + 2H2O.
Щоб перетворити кислу сіль на середню, необхідно подіяти основним гідроксидом:
Ca(HCO3)2 + Ca(OH)2 ® 2CaCO3¯ + 2H2O,
Cu(HSO4)2 + Cu(OH)2 ® 2CuSO4 + 2H2O.
Основні солі - це продукти неповного заміщення гідроксильних груп в молекулі основи кислотним залишком. Основні солі є продуктом неповної нейтралізації багатокислотної основи кислотою, наприклад, (CuOH)2SO4, MgOHCl:
2Cu(OH)2 + H2SO4 ®(CuOH)2SO4 + 2H2O,
Mg(OH)2 + HCl ®MgOHCl + H2O.
Щоб перевести основну сіль у середню, необхідно подіяти кислотою:
2AlOHSO4 + H2SO4 ® Al2(SO4)3 + 2H2O,
MgOHCl+ HCl ® MgCl2 + H2O.
Назви середніх солей утворюються від кореня латинської назви елемента, який утворює кисневмісну кислоту, додаванням суфікса - “ат”, якщо елемент має найвищий ступень окислення, та суфіксу - “іт”, якщо елемент має найнижчий ступень окислення. Назви середніх солей безкисневих кислот утворюються від кореня латинської назви елемента (кислотного залишку) із суфіксом - “ід” (-”ид”), наприклад: CuSO4 - сульфат міді, CuSO3 - сульфіт міді, CuS - сульфід міді, але BaCl2 - хлорид барію, NaNO2 - нітрит натрію.
Назви кислих солей утворюються від назви середньої солі з додаванням префікса “гідро-”, наприклад: Na2HPO4 - гідрофосфат натрію, KH2PO4 - дигідрофосфат калію.
Назви основних солей утворюються від назви середніх солей з додаванням слова “гідроксо-”. Наприклад: MgOHNO3 - гідроксонітрат магнію, Al(OH)2Cl - дигідроксохлорид алюмінію.
Молекули подвійних солей складаються з катіонів двох різних металів та одного й того ж аніону кислотного залишку, наприклад:
KAl(SO4)2 - сульфат калію-алюмінію,
KMgCl3 - хлорид калію-магнію.
В назвах подвійних солей назви всіх катіонів ставляться у родовому відмінку.
Молекули змішаних солей мають у своєму складі різні кислотні залишки, наприклад: MgNO3Cl - хлорид-нітрат магнію, CaClClO - гіпохлорит-хлорид кальцію.
Середні солі одержують такими способами:
1. Взаємодією кислоти з основним гідроксидом:
H2SO4 + Ca(OH)2 ® CaSO4 + 2H2O.
2. Взаємодією кислоти з основним оксидом:
H2SO4 + CaO ®CaSO4 + H2O
3. Взаємодією кислотного та основного оксидів:
SO3 + CaO ®CaSO4
4. Взаємодією основного гідроксиду з кислотним оксидом:
Ca(OH)2 + SO3 ®CaSO4 + H2O
5. Взаємодією металу з кислотою:
Zn + 2HCl ®ZnCl2 + H2
6. Взаємодією металу з неметалом:
Fe + S ®FeS
7. Взаємодією солі з кислотою:
CaCl2 + H2SO4®CaSO4 + 2HCl
8. Взаємодією солі із соллю:
CaCl2 + Na2CO3 ®CaCO3 + 2NaCl
9. Взаємодією солі з основою:
FeCl3 + 3NaOH ®Fe(OH)3 + 3NaCl
10. Взаємодією солі з металом:
Fe + CuSO4 ® Cu + FeSO4.
План:
1. Історія розвитку уявлень про будову атома. Ядро атома. Протони, нейтрони.
2. Квантові числа як характеристика стану електрона в атомі, межі їх змін.
3. Багатоелектронні атоми. Принцип Паулі. Правило Гунда. Правило Клечковського.
4. Будова атомних ядер. Радіоактивність. Типи і властивості радіоактивного випромінювання.
5. Періодичний закон та Періодична система хімічних елементів.
6. Електронні формули атомів хімічних елементів. Явище провалу електронів.
7. Зміна розміру атомів по Періодичній системі.
8. Енергетичні характеристики атомів хімічних елементів.
9. Ступінь оксидації хімічних елементів як фундаментальна величина в неорганічній хімії.
1. Історія розвитку уявлень про будову атома. Ядро атома. Протони, нейтрони. Весь навколишній світ складається із речовин. У природі речовини бувають прості та складні. Прості речовини складаються із однорідних атомів якого-небудь елемента.
Атомом називається найменша частка хімічного елемента, яка зберігає його властивості. Всі речовини складаються із атомів, але атом не є найменшою неподільною складовою частиною речовини, а складається із великої кількості більш дрібних, так званих елементарних частинок, які мають різну природу та властивості. Найбільш важливими із декількох сотен відомих елементарних частинок, які визначають властивість елемента, є протони, нейтрони, електрони та позитрони.
Протони (р) — це частинки, які мають масу, що дорівнює 1 (1 вуглецева одиниця (в.о.), та елементарний позитивний заряд величиною у 4,8 • 10-10 електростатичних одиниць.
Нейтрони (n) - частинки, що не мають заряду, мають масу, яка дорівнює 1 в.о.
Електрони (е-) - частинки, які мають негативний електричний заряд, рівний за величиною заряду протона і масу, рівну 1/1840 частині маси протона (9,1 • 10-28 г).
Позитрони (е+) - частинки, які мають позитивний заряд, рівний за величиною заряду електрона, і такої ж величини масу.
| Елементарна частинка | Заряд | Маса, в.о. |
| Нейтрон, n | не має | |
| Протон, p | + 1 | |
| Електрон, e | - 1 | 1/1840 |
| Позитрон, е+ | + 1 | 1/1840 |
На початку ХХ століття англійський вчений Резерфорд розробив ядерну модель будови атома. Згідно з цією моделлю, атом складається із позитивно зарядженого ядра, в якому знаходяться протони, нейтрони та інші елементарні частинки, а навколо ядра обертаються негативно заряджені електрони. Розрахунки діаметрів атома та ядра показали, що вони відповідно складають 10-8 і 10-12-10-14 см.
Позитивний заряд ядра визначається кількістю протонів у ядрі і дорівнює порядковому номеру елемента в періодичній системі Д.І. Менделєєва. Оскільки атом - електронейтральна частинка, тоді він має таку ж саму кількість негативно заряджених частинок - електронів, як і протонів. Електрони безперервно обертаються навколо ядра по орбітах, які розташовані на енергетичних рівнях і підрівнях.
Елементи відрізняються один від одного кількістю елементарних частинок, з яких складається атом. Електрони утворюють так звану електронну оболонку атома. Так найпростіший елемент водень можна уявити як елемент, що має позитивно заряджене ядро +1, навколо якого обертається один електрон (-1) (рис. 1).
Електрони утримуються в атомі на певній відстані від ядра завдяки дії двох сил: сили електростатичного тяжіння ядра, яка утримує їх в позитивному електричному полі, та відцентрової сили, що виникає в результаті обертання електрона навколо ядра з величезною швидкістю. Рівновага цих двох сил не дає можливості електрону впасти на ядро або відірватись від атома. Постійно рухаючись, електрони заповнюють певну частину простору навколо ядра, утворюючи електронну оболонку атома, яка складається з енергетичних рівнів та підрівнів. Максимальна кількість електронів, які можуть бути на енергетичному рівні, визначається за формулою:
N = 2n2,
де n - порядковий номер енергетичного рівня.
Рух елементарних частинок, що мають дуже незначні величини маси і швидкості, близькі до швидкості світла, не підкоряється законам класичної механіки Ньютона. Для характеристики поведінки мікрочасток застосована квантова механіка Планка, основу якої складає уявлення про дискретність руху та випромінювання енергії, що відбувається не безперервно, а порціями, так званими квантами енергії. Енергія кожної такої порції випромінювання залежить від частоти коливання у відповідності з формулою:
Е = hv,
де h - стала Планка, що дорівнює 6,626 • 10-34 Дж • с,
v - частота коливання, яка залежить від довжини хвилі випромінювання X (v = 1/ X).
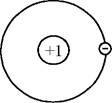
Рис. 1. Ядерна модель будови атома водню.
Датський фізик Нільс Бор, застосувавши основні положення квантової механіки, розрахував можливі орбіти руху електрона в атомі водню. Згідно з розрахунками Бора, можливі радіуси руху електронів у атомі водню відносяться як квадрати цілих чисел:
12: 22: 32:: n2
Ці радіуси відповідають так званим енергетичним рівням, які визначають величину енергії електрона. Чим далі знаходиться енергетичний рівень від ядра, тим вища його енергія. Найменша енергія у електрона, що рухається на першому рівні, із збільшенням порядкового номера рівня енергія електрона зростає. При обертанні на найближчому до ядра рівні електрон не випромінює енергію і атом знаходиться у так званому нормальному (основному) стані. Електрони можуть переходити на більш високий енергетичний рівень при одержанні енергії ззовні у кількості, яка відповідає різниці енергій рівнів. Наприклад, для переходу з рівня 1 на рівень 2 різниця енергії складає:
ΔЕ = Е2 – Е1.
Атом, у якому електрон перейшов на більш високий енергетичний рівень знаходиться у так званому збудженому стані. При зворотньому переході електрону на попередній рівень енергія його випромінюється і атом знову переходить у нормальний (основний) стан. Відповідно до цих уявлень електронна оболонка атома заповнюється електронами поступово, починаючи з першого рівня.
2. Квантові числа як характеристика стану електрона в атомі, межі їх змін. Для опису стану електрона в атомі квантова механіка дає чотири квантові числа, які мають суворо визначені величини.
Головне квантове число n характеризує енергетичний рівень, тобто величину енергії рівня і може мати значення ряду цілих чисел від 1 до n (1...го). Відповідно енергетичні рівні позначаються великими літерами латинського алфавіту, починаючи з К (К, n = 1; L, n = 2; M, n = 3 і т.ін.).
Побічне квантове число (орбітальне) l. На енергетичному рівні електрони можуть обертатись як по кругових, так і по еліптичних орбітах. В цьому випадку запас їх енергії буде відрізнятись. Отже, в межах рівня є енергетичні підрівні. Орбітальне квантове число вказує на можливу кількість підрівнів на енергетичному рівні і може набувати значення від 0 до (n-1). Відповідно підрівні позначаються малими літерами латинського алфавіту, починаючи з s (s, p, d, f). Так, на енергетичному рівні К (n = 1), орбітальне число буде мати значення l = n - 1 = 0, тобто одне значення і тому на першому енергетичному рівні буде тільки один підрівень s.
На другому рівні (n = 2) l = 0 підрівень s
l = 1 підрівень p
На третьому рівні (n = 3) l = 0 підрівень s
l = 1 підрівень p
l = 2 підрівень d
Магнітне квантове число m показує число можливих орбіталей в межах підрівня. Воно може мати значення від 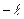 до
до  включно 0, тобто всього може приймати значень
включно 0, тобто всього може приймати значень  . Так, для підрівня s побічне квантове число має тільки одне значення,
. Так, для підрівня s побічне квантове число має тільки одне значення,  ; магнітне буде мати теж одне значення, отже, на цьому підрівні може існувати лише одна орбіталь. На підрівні p магнітне квантове число має три значення +1, 0, -1, на цьому підрівні можуть бути три орбіталі. Відповідно для підрівня d число значень магнітного числа буде п'ять (+2, +1, 0, -1, -2), отже і орбіталей може бути п'ять.
; магнітне буде мати теж одне значення, отже, на цьому підрівні може існувати лише одна орбіталь. На підрівні p магнітне квантове число має три значення +1, 0, -1, на цьому підрівні можуть бути три орбіталі. Відповідно для підрівня d число значень магнітного числа буде п'ять (+2, +1, 0, -1, -2), отже і орбіталей може бути п'ять.
Спін електрона s (від англійського слова "spin" - веретено, обертання навколо власної осі) показує, що електрон може обертатись і навколо власної осі. Таких можливих напрямків обертання існує тільки два: за та проти годинникової стрілки, отже, квантова механіка дає два значення спіну електрона +1/2 та -1/2. Обертання електрона навколо власної осі подібне до руху електричного струму по замкнутому контуру і викликає появу магнітного поля, силові лінії якого будуть спрямовані у просторі за правилом гвинта (правило буравчика).
3. Багатоелектронні атоми. Принцип Паулі. Правило Гунда. Правило Клечковського. Для складання електронних формул використовують три правила, за якими, згідно з сучасною теорією будови атома, утворюються електронні оболонки атомів.
Перше правило - принцип Паулі, який формулюється так: в атомі не може бути двох електронів з однаковими значеннями всіх чотирьох квантових чисел. За цим принципом можна розрахувати максимальне число електронів на орбіталі, підрівні, рівні. Так, на s-орбіталі не може бути більш ніж 2, на р-орбіталі - 6, на d-орбіталі - 10 електронів. Звідси, максимальне число електронів, яке може бути на 1 енергетичному рівні - 2, на другому енергетичному рівні - 8, на третьому - 18 і т.ін.
Друге правило - правило найменшого запасу енергії (правило Клечковського): заповнення електронами енергетичних підрівнів відбувається зі зростанням їх енергії, яка характеризується сумою  . В багатоелектронних атомах заповнення електронами енергетичних рівнів і підрівнів відбувається залежно від їх енергії у такій послідовності:
. В багатоелектронних атомах заповнення електронами енергетичних рівнів і підрівнів відбувається залежно від їх енергії у такій послідовності:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f і т. ін.
Третє правило - правило Гунда. Воно стосується заповнення електронами еквівалентних орбіталей. При складанні електронних формул атомів елементів ми повинні пам'ятати, що число електронів дорівнює позитивному заряду ядра, тобто порядковому номеру елемента. Позначаючи енергетичні рівні числами відповідно до головного квантового числа, підрівні - літерами латинського алфавіту (s, р, d, f), а число електронів на підрівні у вигляді показника ступеня над підрівнем, одержимо електронну формулу атома. Наприклад, елемент №1 водень Н має в ядрі один протон (тобто заряд ядра +1), відповідно навколо ядра на s-підрівні першого рівня обертається один електрон:
№1 Н 1s1;
у гелію заряд ядра +2 і навколо ядра обертаються два електрони:
№2 He 1s2.
Це максимальна кількість електронів, яка може бути на першому рівні, і, зокрема, на s-підрівні. Отже, перший період періодичної системи не може мати більше двох елементів.
При збільшенні порядкового номера елементів буде збільшуватись як позитивний заряд ядра, так і кількість електронів, що обертаються навколо нього. Але ці електрони вже будуть заповнювати підрівні наступного енергетичного рівня. Так, елемент №3 Li вже буде мати один, а №4 Be - два електрони на підрівні 2s
№3 Li 1s2 2s1, №4 Be 1s2 2s2.
Після завершення підрівня 2s, електрони заповнюють підрівень 2р:
№5 B 1s2 2s2 2р1,
№6 С 1s2 2s2 2p2,
№7 N 1s2 2s2 2p3,
№8 О 1s2 2s2 2p4,
№9 F 1s2 2s2 2p5
Останній елемент у другому періоді неон має повністю заповнений електронами зовнішній шар: №10 Ne 1s2 2s2 2p6.
Елементи третього періоду будуть мати електрони вже на третьому енергетичному рівні. Наприклад, №11 Na 1s2 2s2 2p6 3 s1.
Існує ще одна, зручна для розуміння можливих хімічних властивостей елементів, форма запису електронних формул у вигляді енергетичних комірок. Енергетична комірка схематично позначається клітинкою. Для комірки маємо три квантові числа  , що є координатами певної орбіти, на якій обертається електрон в атомі. Електрони в цих комірках показують відповідними стрілками, спрямованими вгору ↑ та ↓. Ці стрілочки показують напрямок магнітних силових ліній (спін) електронів, а їх кількість відповідає кількості електронів на орбіті. Так, для атома водню електронній формулі 1s1 відповідає одна комірка, на підрівнях p i d кількість орбіт відповідно 3 та 5.
, що є координатами певної орбіти, на якій обертається електрон в атомі. Електрони в цих комірках показують відповідними стрілками, спрямованими вгору ↑ та ↓. Ці стрілочки показують напрямок магнітних силових ліній (спін) електронів, а їх кількість відповідає кількості електронів на орбіті. Так, для атома водню електронній формулі 1s1 відповідає одна комірка, на підрівнях p i d кількість орбіт відповідно 3 та 5.
Заповнення цих підрівнів електронами здійснюється у відповідності з правилом Гунда: при заповненні електронами енергетичних комірок в межах підрівня, електрони розташовуються спочатку по одному, а потім заповнюють енергетичні комірки по два, тобто таким чином, щоб їх сумарний спін був максимальний.
Атоми елементів, вступаючи у хімічну взаємодію, залежно від будови зовнішнього енергетичного рівня або втрачають електрони (це, як правило, метали), або приєднують їх (неметали). Здатність атома елемента віддавати електрони вважають мірою металічності, приєднувати - мірою неметалічності. Для порівняння металічних властивостей елемента використовують енергію іонізації, неметалічних - спорiдненiсть до електрона або значення відносної електронегативності. Хімічні властивості елементів змінюються періодично зі зміною їх положення у періодичній системі і, відповідно, будови електронної оболонки атомів.
Д.І. Менделєєв встановив, вивчаючи хімічні властивості елементів: в одному періоді містяться елементи, атоми яких мають однакове число енергетичних рівнів, але різну кількість електронів на зовнішньому енергетичному рівні і тому їхні властивості змінюються по періоду від активних металів (IA група - лужні метали) до неметалів (закінчується період інертними газами); число елементів у кожному періоді визначається максимально можливим числом електронів на енергетичному рівні, який заповнюється у атомів елементів цього періоду; число електронів на зовнішньому енергетичному рівні атомів елементів головних підгруп (крім Не) дорівнює номеру групи, в якій міститься елемент; в одній підгрупі містяться елементи, атоми яких мають однакову будову зовнішніх енергетичних рівнів, а, відповідно, і подібні хімічні властивості.
Електронні оболонки інертних газів мають повністю заповнені зовнішні рівні та підрівні, тобто в кожній комірці знаходиться по два електрони. Це енергетично дуже стійка електронна конфігурація і практично "вирвати" електрон із такої оболонки неможливо. Ось чому атоми інертних газів не утворюють валентні зв'язки і не утворюють сполуки, подібні до інших елементів періодичної системи.
4. Будова атомних ядер. Радіоактивність. Типи і властивості радіоактивного випромінювання. Французький вчений A. Беккерель у 1896 р. відкрив здатність сполук 238U випромінювати промені, подібні до рентгенівських. Такі ж самі промені були відкриті М.Кюрі-Склодовською та П. Кюрі для сполук торію, радію і полонію. Здатність речовин до самодовільного випромінювання було названо радіоактивністю, що в перекладі з латинської означає "здатність випромінювати". Радіоактивність може бути виявлена за такими властивостям, які мають промені:
· здатність викликати світіння люмінесцентних матеріалів;
· здатність викликати іонізацію газів;
· здатність засвічувати фоточутливі матеріали.
Вивчення радіоактивності показало, що промені, які випромінюють вказані речовини, не є однорідними. Якщо тоненький пучок променів помістити у електричне або магнітне поле, то виявляється, що вони розділяються на три промені, які по-різному реагують на магнітне та електричне поле. До негативного полюса пластини відхиляється пучок променів, який має позитивну природу - α-промені. Дослідження показали, що це ядра атома гелію, які мають заряд 2+ і масу 4, тобто це He2+, причому вони мають швидкість 22000 км/с.
β-промені, які являють собою потік негативно заряджених частинок - електронів. β-частинки рухаються з різними швидкостями - від 100000 до 300000 км/с.
γ-промені не відхиляються під впливом електричного та магнітного поля. За своєю природою вони подібні світловим променям, але, на відміну від них, характеризуються дуже малою довжиною хвилі та мають велику проникну здатність.
Характерними особливостями природного радіоактивного розкладу слід назвати такі:
1. при радіоактивному розпаді утворюються нові елементи;
2. радіоактивні процеси незворотні;
3. глибина радіоактивного перетворення не залежить ні від температури, ні від тиску, ні від того знаходиться атом у вільному стані чи у сполуках;
4. при перетворенні 1 грам-атома радіоактивної речовини енергія, що виділяється, у міліон разів більша, ніж при любій хімічній реакції.
Згодом у ядрі атома були відкриті нейтрони (n), протони (p) та позитрони (е+).
Таким чином, стало можливим розробити теорію будови ядра атома, яке, за думкою Д. Іваненко (1932), складається із нейтронів та протонів, причому маса атома (масове число) А складається із суми мас нейтронів та протонів, що його утворюють, тобто:
А = Z + N
де Z - це позитивний заряд ядра, який дорівнює порядковому номеру елемента у періодичній системі, а N - число нейтронів у ядрі.
При даному значенні N можуть існувати ядра з різними значеннями А, що обумовлено вмістом різного числа нейтронів. Такі ядра називаються ізотопами даного елемента. Для позначення визначеного ізотопу даного елемента його масове число показують як верхній індекс ліворуч від символу хімічного елемента. Усі ізотопи елемента мають однакові хімічні властивості, але різниця в масах може виявлятися у швидкостях реакцій і деяких термодинамічних властивостях. Такі відмінності суттєві лише для ізотопів водню: протію 1Н, дейтерію 2Н та тритію 3Н, у яких відносні зміни мас ізотопів надзвичайно великі. Для інших елементів вони не суттєві.
Більшість елементів зустрічається у природі як суміш двох чи більше ізотопів. Наприклад, олово складається із суміші 9 ізотопів, починаючи з 112Sn, природний вміст якого складає лише 0,96% до 124Sn (5,94%). Найбільший природний вміст має 118Sn (24,03%). Деякі розповсюджені елементи зустрічаються в джерелах природного походження лише у вигляді одного ізотопу: 27Al, 31P, 55Mn.
Ядра, для яких масове число однакове, а кількість протонів у ядрі різна називаються ізобарами. Наприклад, 40К і 40Са. Виявилось, що до певних кількостей протони та нейтрони можуть утримуватись у ядрі на дуже невеликій відстані одне від одного і утворювати стабільне ядро елемента. Проте згідно сучасної протонно-нейтронної теорії, протони і нейтрони можуть перетворюватись одне в одне з утворенням позитронів та електронів:
· протон → нейтрон + позитрон (p → n + e+)
· нейтрон → протон + електрон (n → p + e-)
· протон + електрон → нейтрон (p + e→ n)
На практиці такі перетворення елементарних частинок спостерігається при радіоактивному розпаді. Сучасна теорія будови ядра вказує, що стабільними являються ядра атомів, у яких співвідношення числа нейтронів до числа протонів n/p складає величину, яка приблизно дорівнює одиниці. Наприклад, для елемента №12 Mg це співвідношення складає 12: 12 = 1, для № 6 С - 6: 6 = 1, для №16 S - 16: 16 =1. Якщо це співвідношення приймає значення, більше за 1, тоді такі ядра стають менш стійкими і починають розпадатись з утворенням менших частинок і випромінюванням різного типу променів. Цей розпад з відщепленням елементарних частинок буде тривати до утворення стабільного елемента. Сукупність усіх продуктів розпаду радіоактивного елемента складає радіоактивний ряд. Материнським елементом називається елемент з якого розпочинається радіоактивний ряд, дочірнім елементом - безпосередній продукт розпаду.
Кількісною характеристикою здатності до радіоактивного розпаду є період напіврозпаду Т1/2 - час, за який інтенсивність радіоактивного випромінювання зменшується наполовину. Існує експериментальна формула для розрахунку періоду напіврозпаду:
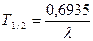
де λ - константа розпаду, с-1
Важливим виявилось те, що радіактивність - це властивість атомів, яка не залежить від того, чи це буде елемент у вільному стані, чи це буде атом елемента у його сполуці.
Типи радіоактивного розпаду. В залежності від того, які елементарні частинки приймають участь у радіоактивному розпаді, розрізнюють такі типи радіоактивного розпаду:
· α-розпад. Цей розпад супроводжується виділенням α-частинки і утворенням нового елемента, що має порядковий номер, менший на дві одиниці, а масове число - на чотири одиниці:

· β-розпад (β-електронний). Розпад супроводжується випромінюванням електрона, що є результатом перетворення нейтрона у протон: n→ р + е-, тобто порядковий номер елемента збільшиться на одиницю, а масове число не зміниться:
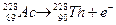
Ці елементи будуть ізобарами: при однаковій атомній масі вони мають різний позитивний заряд ядра.
· К-захват або е-захват. Розпад супроводжується перетворенням протона в нейтрон в результаті захоплення електрона з енергетичного рівню К за схемою: р + е-→ n і порядковий номер утвореного елемента зменшиться на одиницю внаслідок зменшення протонів у ядрі:

· β+-розпад (β-позітронний). Випромінювання позітронів відбувається за рахунок перетворення протонів у ядрі у нейтрони за схемою: р→ n + е+, що приводить до збільшення порядкового номера продукту розпаду:
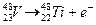
Першу штучну ядерну реакцію здійснив у 1919 році англійський фізик Е. Резерфорд. Діючи на атоми азоту потоком α-частинок, йому вдалося здійснити такий процес:

Звичайно застосовують скорочені записи ядерних реакцій. При цьому нижні індекси в материнському та дочірньому ядрах не пишуть. Вони відповідають порядковим номерам відповідних елементів і визначаються за таблицею Д.І. Менделєєва. В дужках зображають: на першому місці - частинку, яка "бомбардує", на другому - вторинні частинки ядерної реакції. В радіоактивних процесах, які проходять самочинно, частинки, що "бомбардує", немає, тому в дужках ставлять тире. Наприклад, ядерну реакцію

в скороченому вигляді можна зобразити таким чином:

Радіоактивні ізотопи знайшли широке застосування в різноманітних галузях науки і техніки. Вони використовуються у приладах промислового контролю, наприклад, для визначення дефектів у металах і сплавах; при випробовуваннях зносостійкості двигунів; в медицині для діагностики та лікування; в радіоактиваційному аналізі та ін.
Більшість нових елементів періодичної системи Д.І. Менделєєва, відкритих у другій половині ХХ століття, одержано саме при бомбардуванні атомів одних елементів атомами інших з використанням складних систем, які дозволяють розігнати атоми до великої швидкості з використанням змінного електричного та магнітного поля. Так, при бомбардуванні елемента №99 Es (ейнштейній) був отриманий елемент №101 менделеєвій (Md) з періодом напіврозпаду 30 хвилин:

Елемент №102 нобелій (No) був одержаний шведськими вченими при бомбардуванні елемента №96 кюрію атомами ізотопу вуглецю 13С:

Ядерні реакції мають величезний енергетичний потенціал, проте дуже важко знайти безпечний механізм управління ними. Використання їх у мирних цілях небезпечне для навколишнього середовища та існування людства. У ряді країн провадять інтенсивні дослідження з метою одержання керованого процесу термоядерного синтезу. Вирішення цієї проблеми призведе до практичного використання невичерпних запасів внутрішньоядерної енергії. Важливою проблемою енергетики є зберігання відходів атомної промисловості. Ці відходи можна захоронити під землю. Однак, немає повної впевненості у тому, що при зберіганні вони не попадуть у підземні води. Тому необхідне подальше вивчення цієї проблеми.
5. Періодичний закон та Періодична система хімічних елементів. На сьогодні існує 3 формулювання періодичного закону. Формулювання Д.І.Менделєєва. В цьому формулюванні за основу взята атомна маса хімічних елементів (простих речовин) і звучить воно так: властивості речовин (хімічних елементів) змінюються періодично по мірі зростання атомних мас. Відповідно до цього формулювання атоми з однаковою атомною масою мають мати однакові властивості, а це не так (ізобари). Відповідно до цього формулювання є порушення по місцю знаходження хімічних елементів у таблиці (Ar і K, Th і Pa, Te і I,Co і Ni). А якщо врахувати явище ізотопії, то закон Менделєєва зовсім не відповідає його змісту. Проте, заслуга Д.І.Менделєєва полягає в тому, що він, на відміну від інших, прогнозував хімічні елементи, які в той час були невідомі.
Формулювання сучасне (ядерне). Воно є більш відповідним до змісту закону: хімічні властивості, а також інші властивості змінюються періодично по мірі зростання заряду ядра атома. Тоді недоліки атомного формулювання виправляються (їх немає). Заряд ядра атома збільшується безперервно, хімічні властивості змінюються періодично. Відповідно до цього формулювання заряд ядра Ar 18, K 19, Co 27, Ni 28. Проте дане формулювання містить недоліки: цей закон відкрили фізики-ядерники, у зв'язку з напруженою роботою по створенні ядерної зброї; і ядро атома безпосередньо не впливає на хімічні властивості.
Формулювання сучасне. Вперше застосували в американській літературі і на сьогодні воно найточніше. Хімічні властивості визначаються електронною будовою, тобто електрони приймають участь в хімічних процесах (зв'язок полярний і неполярний, окисно-відновні процеси, комплексні сполуки). Електрони теж є елементарними частинками, фізичними об'єктами дослідження, але крім цього в атомах є електрони, які зумовлюють хімічні властивості. Таким чином, сучасне формулювання є таким: Властивості елементів, особливо хімічні, змінюються періодично по мірі зростання порядкового номера. Це пояснюється тим, що по мірі зростання порядкового номера періодично змінюється електронна будова.
Порядковий номер - це є величина, яка визначає місце хімічного елемента в періодичній системі. Таким чином порядковий номер визначає хімічні властивості елемента.
Хімічний елемент - це вид атомів з однаковою електронною будовою, яка визначає хімічні властивості. Електронна будова природно визначається зарядом ядра, тобто кількістю протонів, які входять до складу ядра. В ядрі, крім протонів є і нейтрони. Маса протона і нейтрона (нуклони) в хімії приймаються за одиницю - 1 а.о.м. Протони мають заряд +1 (умовно), нейтрони електрично нейтральні. Що стосується електронів, то маса кожного з них нескінченно мала, в хімії масою електрона нехтують.
Масове число - це сума протонів і нейтронів у ядрі: A=Z+N, де Z - сума протонів; N - сума нейтронів. Масове число повинно бути цілим. Маса одного нуклону = 1а.о.м. Маса атома визначається масою ядра і є цілим числом. Не дивлячись на те, що маса окремих атомів є цілим числом, атомні маси хімічних елементів в абсолютній більшості є дробові числа.
В періодичній таблиці наведені не маси окремих атомів, а записані маси атомів хімічних елементів. Поняття «хімічний елемент» включає в собі декілька атомів з однаковою електронною будовою і тоді атомна маса хімічного елемента є середньою масою всіх атомів.
Відомо, що хімічні властивості головним чином визначаються електронною будовою. Число електронів у атомі дорівнює порядковому номеру хімічного елементу.
Ізотопи - атоми, що містять однакове число протонів, але різне число нейтронів.
Ізобари - атоми, що містять різне число протонів і нейтронів, але однакове масове число (Ar 18p, 22n, K 19p, 21n, Ca 20 p, 20n).
Ізотони - атоми, що містять однакове число нейтронів, але різне число протонів.
7. Зміна розміру атомів по Періодичній системі. Для визначення розміру атома існують спеціальні одиниці Ангстреми.
1А =10-8см=10-10м
Існує також інша одиниця для розміру атома - нанометр.
1 нм=10-9м. 10А = 1нм
Наприклад: атом Феруму має розмір (атомний радіус) 1,241 А. Fe (1,24 А), Li (1,52 А), Cs (2,655 А).
Якщо атом переходить в іон, то розмір буде збільшений або зменшений. Якщо відбувається окислення атома (атом віддає електрон) тобто перетворюється в катіон, то розмір буде зменшуватися
Li0-1e=Li+
А якщо атом приймає електрони і перетворюється в аніон, то розмір його збільшується
O0 + 2e = O-2. (0,604 А - 1,40 А).
По періодах при переході від першого елементу до наступних розмір атома зменшується тому що збільшується заряд ядра при однаковій кількості енергетичних рівнів. В другому і третьому періоді зменшення розмірів атомів спостерігається на протязі 8 елементів. У IV та V періодах зменшення атомного радіусу спостерігається на протязі 18 елементів, у V - також, у VI періоді - на протязі 32 елементів. В цей період включаються 14 лантаноїдів. І тоді на протязі 14 лантаноїдів буде відбуватися зменшення розмірів атомів, тобто відбувається так би мовити стиснення атомів. Це явище зменшення розміру атомів лантаноїдів називається лантаноїдне стиснення. Для лантаноїдів і актиноїдів це стиснення називається f- стиснення (4f, 5f).
Лантаноїдне стиснення сильно впливає на розмір атомів хімічних елементів, які йдуть після них. В першу чергу сильно заниженим буде розмір Hf. Тому після лантаноїдів ідуть благородні метали (платинові) Pt, Au, які є пасивними (бо малий розмір атомів).
Розмір атомів змінюється також по підгрупах. В головних підгрупах розмір атомів збільшується, тому що збільшується кількість енергетичних рівнів. Розмір атома повинен був би зменшитись за рахунок збільшення заряду ядра (3Li, 87Fr). Але при збільшенні кількості енергетичних рівнів виникає ефект екранування ядра, що приводить до збільшення розміру.
В побічних підгрупах розмір атома збільшується при переході від першого до другого елемента Ti, Zr, Hf, а при переході від другого до третього розмір атомів не змінюється, бо це компенсується лантаноїдним стисненням. Відповідно, Hf більш пасивний, ніж Zr, бо у гафнію заряд більший, а розмір такий як у цирконію.
8. Енергетичні характеристики хімічних елементів. Кількісними характеристиками активності хімічних елементів є наступні енергетичні характеристики, які розраховуються на один моль атомів в одиницях енергії (еВ- електрон вольт):
· енергія іонізації,
· енергія спорідненості до електрона,
· електронегативність.
Енергія іонізації (Ei) - це енергія, яка витрачається для того, щоб відірвати електрон від нейтрального атома. Розглянемо на прикладі елементів ІІ періоду.
Li0 - 1e = Li+ - Ei(Li); Ei(Li) = 5,392eV
Цей процес реальний в хімічних реакціях, тому що Li має ступінь оксидації +1. F0 - 1e = F+ - Ei(F); Ei(F)=17,42eV
Цей процес не є хімічним, тому що F у сполуках ніколи плюсом не буває. Цей процес не природній для хімічних реакцій, а фізично можна поміряти (в іонізаційних трубках).
Енергія іонізації металів менша, ніж енергія іонізації неметалів, тому що метали - це ті елементи, які віддають електрони, а неметали - ті, які їх приєднують. По величині енергії іонізації можна характеризувати активність металу: чим менша енергія іонізації, тим більш активний метал.
Що стосується неметалів, то їх активність вимірюють по енергії спорідненості (Есп) до електрона - показує, скільки виділяється енергії в результаті приєднання одного електрону до нейтрального атома.
Li0 + 1e = Li-1 + Eсп (Li);
Процес відновлення атомарного атома Li не є природнім. Практично не відбувається, тому що Eсп (Li) ~ 0.
F0 + 1e = F-1 + Eсп (F); Eсп (F) >> Eсп (Li)
Фтор дуже енергійно приєднує електрони і в нього велике значення спорідненості до електрона.
По величині спорідненості можна характеризувати активність неметалів: чим більша спорідненість, тим сильніші неметалічні властивості, тим сильніший буде окисник.
Таким чином активність металів визначається енергією іонізації, а активність неметалів визначається енергією спорідненостю до електрона.
Але поряд з металами і неметалами існують проміжні хімічні елементи, для яких можна застосовувати і енергію іонізації, і енергію спорідненості. Загальною енергетичною характеристикою в цьому випадку є та, яка об'єднує енергію іонізації і енергію спорідненості до електрону - це і є електронегативність (ЕН).
Електронегативність є характеристикою для всіх хімічних елементів, вона представляє собою суму абсолютних величин енергії іонізації і енергії спорідненості до електронів:
ЕН = Еі + Есп
EH(Li) = Еі (Li) + Есп(Li) = 5,392eV
EH(F) = 17,42eV + Eсп(F)
ЕН металів як правило значно менша, ніж неметалів. Вона включає величину Еі, яка показує на скільки легко або важко атом віддає електрон. Есп показує, як енергійно атом приєднує електрони.
Для зручності електронегативність літію умовно приймають за 1. Якщо брати F, то він має найбільшу із усіх елементів електронегативність, яка дорівнює 4. Метали більш активні ніж Li мають електронегативність менші за 1. Наприклад у Cs=0,7.
Розмір атомів повністю зв'язаний з електронегативністю і є оберненими величинами до електронегативності. Наприклад F має найбільшу електронегативність і найменший атомний радіус. А у Cs найбільший атомний радіус і найменша ЕН. ЕН елементів ІІ періоду змінюється прямолінійно від Li до F.
| Li | Be | B | C | N | O | F |
| 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 |
Поняття енергії іонізації, Есп, ЕН не застосовується для гелію, аргону і неону. Не плутати Еі та Есп як однакові величини зворотних процесів.
Li0 - 1e = Li+ - Ei (Li)
Li+ + 1e = Li0 + Ei (Li)
Li0 + 1e = Li- + Eсп (Li)
Процес 1 і процес 2 - це зворотні процеси і для них енергії будуть одинакові, але з оберненим знаком. Що стосується спорідненості до електрона, то у випадку процесу 2 електрон приєднується до атома, а не до іону. Електронегативність водню =2,2.
ПИТАННЯ ДЛЯ САМОСТІЙНОГО КОНТРОЛЮ:
1. Яку інформацію про стан електрона в атомі можна отримати за значенням певного квантового числа: а) головного n; б) орбітального l; в) магнітного m; г) спінового s?
2. Значення якого квантового числа необхідно знати, щоб визначити розміщення електрона: а) на енергетичному рівні; б) на енергетичному підрівні?
3. Як, використовуючи правило Клечковського, можна скласти енергетичну шкалу, яка відображає послідовність розміщення електронів в атомі?
4. Як можна визначити максимально можливе число електронів: а) на енергетичному рівні; б) на енергетичному підрівні; в) на орбіталі?
5. Які випадки «провалу» електронів на прикладі елементів IV періоду вам відомі? Як пояснюються ці випадки?
6. Як визначити належність елемента до певної електронної родини?
7. Як за електронною будовою атома хімічного елемента можна визначити, чи є елемент металом або неметалом?
8. Як за електронною будовою атома хімічного елемента можна спрогнозувати його валентні можливості?
9. Яких правил необхідно дотримуватися, щоб скласти електронну формулу та електронно-графічну схему атома хімічного елемента?
10. Чому у запропоноване Д. І. Менделєєвим формулювання періодичного закону з часом було внесено зміни?
11. Як можна пояснити випадки розміщення деяких хімічних елементів у ПС з порушенням закономірності щодо зростання їх атомної маси (Калій / Аргон, Кобальт / Нікель, Телур / Йод)?
12. Де у ПС розміщені s-, p-, d- та f-елементи?
13. Які періоди називаються короткими, а які - довгими?
14. Які елементи утворюють головні підгрупи, а які - побічні?
15. В яких групах ПС знаходяться елементи, що утворюють леткі сполуки з Гідрогеном?
16. Яких елементів у ПС більше: металів чи неметалів?
17. Як змінюються металічні властивості елементів у головних підгрупах і періодах?
18. Чому у d- та f- елементів значення атомних радіусів мають близькі значення?
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 2610; Нарушение авторских прав?; Мы поможем в написании вашей работы!