
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Секреция факторов патогенности 1 страница
|
|
|
|
Большинство бактерий способны секретировать протеины, такие как токсины и гидролитические ферменты, в окружающую среду. У грамотрицательных бактерий эти белки должны быть транспортированы через две мембраны клеточной оболочки, и различные системы могут обеспечивать этот процесс. Все эти системы должны специфически распознавать свои субстраты и облегчать секрецию без нарушения целостности клеточной оболочки. Однако для достижения такой цели эти системы используют разные механизмы и отличаются друг от друга по своей сложности.
Две из семи более или менее детально охарактеризованных систем (рис. 1) относятся к так называемым двухэтапным (или двухшаговым). Первый этап такой секреции заключается в переносе предназначенного для секреции белка из цитоплазмы бактериальной клетки в периплазматическое пространство. Для его осуществления у бактерий существует два механизма. Один из них называется двуаргининовый путь (в английской аббревиатуре - ТАТ, от pathway от t wo- a rginine t ranslocation), второй – Sec-путь (от английского sec retory – секреция).
Оба эти пути перемещения белков через мембраны функционируют в клетках организмов всех уровней клеточной организации – соответствующие им белки обнаружены у архей, эубактерий и эукариот. Sec-путь предназначен для транспорта белков, не прошедших пострансляционный фолдинг, в то время как ТАТ-путь обеспечивает проведение через мембрану белков, полностью принявших характерную для их активной формы пространственную конформацию.
У прокариот, в том числе и патогенных, Sec-путь обеспечивается цитоплазматическим белком SecА и тремя интегрированными в цитоплазматическую мембрану белками SecY, SecE и SecG. Белки, предназначенные для транспорта этим путем, имеют на своем N-конце сигнальную последовательность, с которой еще во время трансляции связывается белок SecА.
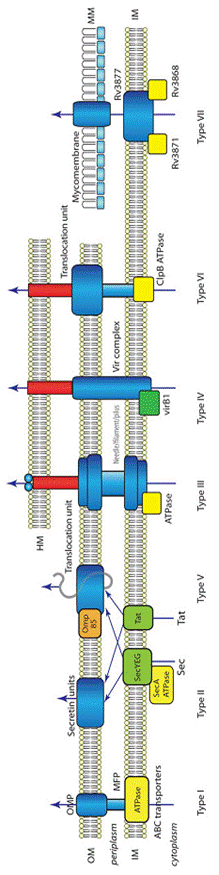
| Рис. 1. Бактериальные системы секреции белков и нуклеопротеидов. HM – мембрана клетки организма-хозяина; IM – внутренняя мембрана бактериальной клетки; OM – наружная мембрана клетки грамотрицательных бактерий; MM – наружная мембрана клетки микобактерий (микомембрана); OMP – белки, интегрированные в наружную мембрану (outer membrane proteins); MFP – белки, обеспечивающие соединение внутренней и наружной мембран (membrane fusion proteins). Остальные пояснения приводятся в тексте при описании систем секреции. |
Далее самостоятельно или с помощью белка-шаперона SecB (этот шаперон нужен некоторым белкам для предотвращения сворачивания уже готовой белковой цепи в нативную структуру) SecА-белок доставляет направляющийся на секрецию белок к тому месту внутренней мембраны, где находятся белки SecY, SecE и SecG. SecА прикрепляет секретируемый белок к белку SecY и одновременно обеспечивает процесс транслокации энергией, поскольку обладает АТФазной активностью. Транслоцируемый белок через образованную белками SecY, SecE и SecG пору перемещается в периплазматическое пространство, и специальная пептидаза отщепляет от него сигнальную последовательность, после чего освободившийся от связи с мембраной белок может принять нативную конформацию.
ТАТ-путь реализуется для белков, у которых в сигнальной последовательности, тоже расположенной на N-конце, имеется характерное сочетание аминокислотных остатков с двумя остатками аргинина: S/TRRXFLK (в расшифрованном виде слева направо - остатки серина, треонина, два остатка аргинина, любой аминокислотный остаток, фенилаланина, лейцина, лизина). Еще раз подчеркнем, что через ТАТ-систему проводятся белки уже в своей окончательной конформации и чаще всего это белки, включающие небелковый компонент, например содержащий металлы кофактор. Поэтому канал, который формирует ТАТ-система в мембране имеет диаметр, позволяющий пройти белкам с поперечными размерами около 70 ангстрем, тогда как пора в Sec-пути имеет диаметр соответствующий толщине α-спирали белковой молекулы – около 12 ангстрем. Для формирования широкого канала в ТАТ-пути объединяются несколько десятков молекул белка TatA, которые первоначально встроены в мембрану как отдельные субъединицы. В то же время, при выведении в периплазму не принявшего окончательную конформацию белка по Sec-пути, достаточно иметь в мембране тример из белков SecY, SecE и SecG.
Последовательность происходящих при использовании ТАТ-пути событий иллюстрирует рисунок 2. На первом этапе предназначенный для секреции белок связывается с комплексом TatC, который специфически узнает последовательность S/TRRXFLK в сигнальном пептиде. Это вызывает перестройку в находящемся рядом комплексе TatB, что приводит к созданию в этом месте мембраны протонного градиента. Наличие протонного градиента и связанного предназначенного для секреции белка приводит к перемещению отдельно расположенных в мембране молекул TatА-белка и их олигомеризации в кольцевую структуру. Вокруг секретируемого белка объединяется несколько десятков молекул (в среднем их количество определено как 25), и эта кольцевая структура имеет внутренний диаметр, достаточный для прохождения белка в периплазму. После этого начинается третий этап. Предположительно с участием протонного градиента белок втягивается в образовавшуюся пору, и специальная мембранная пептидаза отрезает белок от сигнальной последовательности. После того, как секретированный белок оказывается в периплазме в свободном состоянии, осуществляется этап 4 – переход ТАТ-системы в исходное состояние. При появлении в цитоплазме новых молекул с соответствующими сигнальными пептидами процесс секреции повторяется.
У архей и грамположительных бактерий, не имеющих расположенных поверх клеточной стенки мембран (за исключением микобактерий, клеточная стенка которых имеет особые свойства и называется микомембраной), Sec- и ТАТ-пути могут обеспечивать выведение некоторых белков непосредственно в окружающую среду.

| Рис. 2. Схема функционирования ТАТ-системы. Комплекс TatB, изображенный для упрощения рисунка как единичная структура, состоит из шести молекул TatB, комплекс TatC – из 8 молекул TatC. Количество изображенных отдельно друг от друга молекул TatA точно неизвестно, но должно составлять несколько десятков. Символом RR и красным цветом обозначен сигнальный пептид на N-конце секретируемого белка, содержащий последовательность с двумя остатками аргинина.PMF - силы протонного градиента (от англ. proton-motif force). Описание этапов функционирования (1 – 4) приведено в тексте. |
У грамотрицательных бактерий они проявляют себя как первые ступени двуступенчатых системам секреции, каковыми являются система секреции типа II (T2SS) и система секреции типа V (T5SS).
В остальных пяти системах секреции транспорт белков обеспечивается специальными каналами, непосредственно соединяющими цитоплазму бактериальной клетки с окружающей средой или же цитоплазмой клетки организма-хозяина.
Одной из таких систем является система секреции типа I или сокращенно T1SS. Общая схема строенияэтой системы включает три основных компонента: АТФ-связывающую кассету (сокращенно АВС от англ. A TP- b inding c assette); белки, обеспечивающие соединение мембран (сокращенно MFP от англ. m embrane f usion p rotein) и белки, закрепленные в наружной мембране (сокращенно OMFs от англ. o uter m embrane f actors),
Одним из примеров такой системы считается система, обеспечивающая секрецию a-гемолизина (белка HlyА) энтеропатогеными E. coli, которая формируется из белков HlyB (функционально соответствует АВС), HlyD (соответствует MFP) и TolC (соответствует OMF). У бактерий других видов белки T1SS и кодирующие их гены носят различные названия, но функционально они будут соответствовать АВС-белку; белку, соединяющему мембраны, и порообразующему белку. Такие системы обеспечивают секрецию токсинов, металлопротеаз и других гидролитических ферментов у многих грамотрицательных бактерий.
Механизм их действия, как считается, одинаков и состоит в общих чертах в том, что АВС-белок в присутствии молекул АТФ узнает определенную предназначенную для секреции белковую молекулу по локализованной у С-конца последовательности, которая называется секреторным сигналом. Это было четко продемонстрировано на химерных белках, в которых к секреторному сигналу присоединяли различные не секретируемые в норме белки. Хотя не все химеры, в зависимости от размеров и структуры «белков-пассажиров», секретировались одинаково эффективно, практически всегда отмечалось, что их взаимодействие с АВС-белком имеет место. Многие из секретируемых через систему первого типа белков имеют определенное сходство в структуре, например, богатые глицином повторяющиеся последовательности, которые играют роль в связывании ионов Са2+ и в приобретении белковой цепью определенной третичной структуры. Это, как считается, может быть важным для «проталкивания» молекулы через аппарат секреции, который после связывания с АВС-белком субстрата изменяется: мембрансвязывающий белок меняет конформацию (условно говоря, удлиняется), присоединяется к порообразующему белку и образуется сквозной канал, обеспечивающий одношаговую секрецию.
По своей первичной последовательности АВС-белки различных организмов образуют большое семейство, члены которого выявлены у многих про- и эукариотических видов, способных к выделению белков с затратами АТФ. Все эти белки обязательно имеют гидрофобный трансмембранный домен и АТФ-связывающий сайт в гидрофильной части молекулы. Порообразующие белки, в частности TolC, в наружной мембране представляют собой тример в виде кольца с наружным диаметром 5,8 нм, причем значительная часть такой структуры выпячена в периплазму, что, вероятно, облегчает слияние с мембрансвязывающим белком. Считается, что канал внутри такой структуры закрыт и открывается только тогда, когда АВС-белок связывает субстрат и мембрансвязывающий белок вследствие этого контактирует с порообразующей структурой. После того как секреция осуществлена, белки аппарата разъединяются и пора вновь оказывается закрытой. Собственно этот этап считается АТФ-независимым (гидролиза АТФ при этом не происходит), но предположительно может зависеть от создаваемого протонами мембранного потенциала.
Система секреции типа II ( или T2SS) очень широко распространена среди грамотрицательных бактерий из-за чего ее часто называют общий секреторный путь или GSP (от англ. g eneral s ecretory p athway). Примерами использования такой системы могут быть секреция пуллуланазы клетками Klebsiella oxytoca и Xcp-секреция у Pseudomonas aeruginosa. Секретируемые через такую систему белки синтезируются с N-концевой сигнальной последовательностью, которая направляет их к «секреторной машине», локализованной во внутренней мембране. После транслокации через внутреннюю мембрану по Sec-пути белки задерживаются в периплазматическом пространстве, где они приобретают нативную или близкую к нативной конформацию. Изменение конформации осуществляется с помощью специальных специфических для каждого белка шаперонов (англ. chaperon – дуэнья, тетка-воспитательница) и общих изменяющих конформацию белков, таких как Dsb-белки, катализирующие образование дисульфидных мостиков у любого белка, в последовательности которого есть серусодержащие аминокислотные остатки в нужном сочетании и положении.
Периплазматическое изменение конформации (periplasmic folding) является необходимой предпосылкой для следующего, второго, этапа секреции – перемещения через наружную мембрану. Секреторный сигнал для этого второго этапа формируется только при возникновении полной (третичной или четвертичной) структуры предназначенного для секреции протеина и выражен только тогда, когда этот белок приобретает свою окончательную, нативную, конформацию. Исходя из того, что секретируемые этим путем белки являются сложными по структуре и даже мультимерными, как, например, холерный токсин, предполагается, что проходящий через клеточную стенку и наружную мембрану канал должен иметь большой внутренний диаметр (около 95 ангстрем) и должен очень аккуратно открываться, чтобы не нарушать защитную функцию наружной мембраны. Обслуживающая этот этап секреции второго типа «молекулярная машина» включает обычно 12-15 белков.
Если рассмотреть этот путь секреции на примере бактерий Pseudomonas aeruginosa (рис. 3), то у них для второго этапа секреции типа II необходимы продукты 12 генов, xcpP-xcpZ и xcpA (мутация в любом из этих генов приводит к накоплению секретируемых белков в периплазме). Гены xcpPQ и xcpR-Z образуют два разнонаправлено транскрибируемых оперона, тогда как xcpA расположен в совершенном другом месте хромосомы.
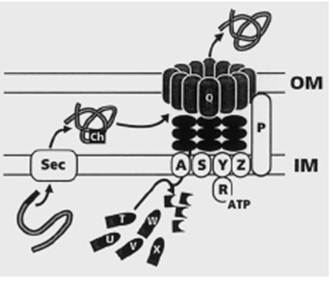
Рис. 3. Система секреции типа II Pseudomonas aeruginosa. Sec –белковый аппарат, обеспечивающий выход белка в периплазму (см. стр. 98). IM – внутренняя мембрана; OM – наружная мембрана; ch – периплазматический шаперон; RATP – белок XcpR, обладающий АТФазной активностью. Буквы латинского алфавита на изображениях белков соответствуют буквенным обозначениям белков Xcp.
Из 12 кодируемых этими генами белков только один – XcpQ – обнаруживается собственно во внешней мембране, где он формирует стабильный комплекс из 12 одинаковых молекул (12-членный гомоолигомер), имеющий форму кольца с внутренним диаметром 9,5 нм (95 ангстрем). Такие размеры поры во внешней мембране вполне обеспечивают выход белков, уже принявших в периплазме окончательную нативную структуру.
Из белков, закрепленных во внутренней мембране, особое внимание следует уделить белку XcpА. Он обладает протеазной активностью и фактически обеспечивает сборку собственно секреторного аппарата: белки XcpT, U, V, W, X синтезируются как неактивные белки-предшественники и переводятся в активную форму за счет отщепления от С-концевой части белковой цепи именно белком XcpА (рис.3). Из таких процессированных протеазой XcpА белков собирается располагающаяся в периплазме часть секреторного аппарата.
Белки XcpP, S, Y и Z также интегрированы во внутреннюю мембрану, тогда как белок XcpR связывается с внутренней мембраной через белок XcpY, N-концевой домен которого находится в цитоплазме и имеет сродство к XcpR. Сам же белок XcpR имеет АТФ-связывающий участок, так называемый Walker box A, и его отсутствие у мутантов приводит к невозможности секреции. Отсюда предполагаемая роль – обеспечение энергией процесса выведения секретируемого белка из периплазмы в окружающую среду. Функции остальных Xcp-белков еще не выяснены, предполагают, что XcpZ должен взаимодействовать с XcpY, XcpR - c XcpT, a XcpP – c секретином XcpQ. Считают, что этот комплекс Xcp-белков представляет собой динамичную структуру, способную переводить химическую энергию АТФ в механическую энергию движения периплазматической части секреторного аппарата, выводящего секретируемый белок через пору во внешней мембране. Относительно роли белков XcpP и XcpZ предполагается, что именно они контролируют открывание и закрывание канала в наружной мембране путем передачи энергии из цитоплазмы к белку XcpQ.
Из факторов патогенности Pseudomonas aeruginosa через систему типа II секретируются экзотоксин А, эластаза, липаза, фосфолипаза С, щелочная фосфатаза, аминопептидаза и хитинсвязывающий белок.
Система секреции типа III (T3SS), как пока считают, играет центральную роль в реализации патогенности многих грамотрицательных бактерий, как патогенных для человека и животных, так и фитопатогенов, поскольку эта система позволяет вводить факторы патогенности непосредственно в цитоплазму эукариотической хозяйской клетки. Эту систему также еще называют контактным секреционным путем, так как она включается только при контакте с определенной эукариотической клеткой и служит, по крайней мере, у некоторых из изученных в этом плане бактерий, для переключения общих секреторных процессов в оптимальный для патогена режим. Например, у фитопатогенов при внедрении в растение сначала осуществляется секреция пекто-и целлюлолитических комплексов через систему типа II, а затем, когда клеточная стенка растительной клетки разрушена и цитоплазматическая мембрана ее доступна для контакта, бактерия включает систему секреции третьего типа и отключает ранее действующую систему второго типа.
Открытым первым (в 1994 году) и наиболее изученным примером системы секреции типа III является система Yersinia enterocolitica. Девять кодирующих белки этой системы генов, обозначаемых Ysc, высоко консервативны и их гомологи обнаружены у всех бактерий, для которых система третьего типа описана. Восемь из них имеют также гомологию с генами, участвующими в процессах образования жгутиков. Кодируемые этими генами белки, как считают, нужны для формирования специфического, находящегося внутри жгутика канала через внутреннюю мембрану, который обеспечивает экспорт компонентов, необходимых для построения собственно жгутика. Один из этих белков содержит типичную АТФ-связывающую последовательность и очевидно вовлечен в передачу энергии, необходимой как для сборки «секреторной машины», так и для собственно процесса секреции. Белок YscC, не имеющий гомологии с белками биогенеза жгутиков, представляет собой, как указывалось выше, типичный секретин.
В 1998 (Kubori et al., 1998) удалось выделить из внешней мембраны Salmonella typhimurium и изучить с помощью электронного микроскопа структуры, детерминируемые генами системы секреции третьего типа. Оказалось, что по внешним контурам они похожи на инъекционную иглу, у основания которой располагаются два нижних кольца диаметром 40 нм, вероятно локализованных во внутренней мембране, и два верхних кольца, заякоривающих структуру в наружной мембране (рис.4). Предполагается, что секретин может формировать одно или даже два верхних кольца, поскольку очищенный препарат YscC формирует в эксперименте кольцеобразные комплексы сходных размеров. Учитывая описанное сходство с иглой шприца и характер действия (введение секретируемого белка непосредственно в цитоплазму эукариотической клетки), некоторые авторы используют для описания «секреторной машины» третьего типа в полной сборке термин инъектисома.
К белкам секреторного аппарата типа III, помимо структурных белков, образующих инъектисому, относят и так называемые белки-транслокаторы. Эти белки, как считают, проводятся по каналу инъектисомы и обеспечивают прикрепление конца «иглы» к мембране эукариотической клетки и образование в ней поры. Суммарно, для нормального функционирования T3SS необходимо около двадцати

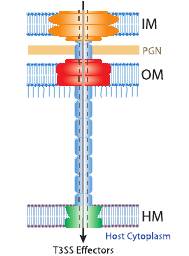
Рис. 4. Строение системы секреции типа III. А - полученное с помощью электронного микроскопа изображение зоны контакта бактериальной клетки и клетки хозяина. Стрелками обозначены инъектисомы. В – инъектисомы в свободном состоянии. С – схема строения инъектисомы бактерий рода Salmonella. Буквами обозначены конкретные белки, формирующие у сальмонелл части аппарата секреции. Схема справа отражает характер действия системы: IM – внутренняя мембрана; PGN – пептидогликановый слой; OM – наружная мембрана; НМ – мембрана эукариотической (хозяйской) клетки.
белков с различными функциями – структурные белки, белки- транслокаторы, а также белки-шапероны, действующие в цитоплазме бактериальной клетки. Предполагается, что они должны предотвращать преждевременную агрегацию секретируемых белков внутри бактерии, а, возможно, и как-то способствовать прохождению их через канал.
Секретируемые через третью систему белки (они в общем смысле называются T3SS-эффекторы) очень различны, часть из них похожи на белки эукариот, но у всех у них, как предполагается, должны быть сигналы секреции у N-конца.
Значимость системы секреции типа III в определении патогенных свойств постоянно подтверждается новыми исследованиями. У ряда патогенов в геноме обнаружены по нескольку кластеров генов, кодирующих аппарат T3SS. В частности, у сальмонелл один из таких кластеров расположен в участке хромосомы, который называется SPI-1 (от англ. S almonella p athogenicity i slands – острова патогенности сальмонелл), второй – в SPI -2. С помощью T3SS, кодируемой генами из SPI-1 (SPI-1 T3SS), сальмонеллы обеспечивают себе проникновение внутрь клеток эпителия кишечника, которые изначально неспособны к фагоцитозу. Сначала передаваемые через инъектисому SPI-1 T3SS эффекторы SipA и SipC стабилизируют и переводят в глобулярное состояние актиновые нити под участком мембраны, к которому прикрепилась сальмонелла. Но они не могут обеспечить образование складок мембраны, которые необходимы для формирования эндосомы. Для этого сальмонелла передает в цитоплазму клетки эпителия следующие T3SS-эффекторы – белки SopE и SopE2. Они активируют регуляторные белки динамических перестроек цитоскелета Cdc42, Rac и RhoG, имитируя действие сигнальных активирующих белков. Одновременно еще один T3SS-эффектор белок SopB/SigD, будучи фосфатидилинозитолфосфатазой, уменьшает количество фосфатидилинозитол-4,5-бифосфата в том участке мембраны, к которому прикреплена сальмонелла, что повышает ее растяжимость. Мембрана начинает прогибаться и ее края смыкаются, образуя эндосому, внутри которой оказывается сальмонелла. Чтобы вернуть цитоскелет клетки в нормальное состояние после образования эндосомы действует еще один T3SS-эффектор – белок SptP. Таким образом эпителиальная клетка сохраняет жизнеспособность после совершения нехарактерного для нее акта фагоцитоза.
Для выживания внутри эндосомы сальмонеллы используют вторую свою систему секреции типа III, кодируемую генами второго острова патогенности (SPI-2 T3SS). Она активируется после попадания сальмонеллы в эндосому и секретирует эффекторы, которые обеспечивают формирование из эндосом специальных мембранных везикул, так называемых SCV (от англ. S almonella - c ontaining v acuole – вакуоль, содержащая сальмонеллу). Образование SCV осуществляется в несколько этапов, включающих предотвращение доставки гидролитических ферментов к SCV, перемещение SCV в прилегающую к ядру область и образование специальных актиновых филаментов, называемых SIFs (от англ. S almonella - i nduced f ilaments – индуцируемые сальмонеллами филаменты).
Для образования SIFs, которые покрывают эндосому с сальмонеллами снаружи, фактически превращая ее в SCV необходимы SPI-2 T3SS-эффекторы SseB, SseC, SseD и SpiC. Такая «шуба» из актиновых волокон препятствует слиянию SCV с элементами комплекса Гольджи, содержащими гидролитические ферменты, а также способствует перемещению SCV в прилегающую к ядру цитоплазму. Здесь дополнительно образуются актиновые филаменты, соединяющие имеющиеся в клетке SCV в единый комплекс и обеспечивающие слияние SCV с определенными элементами комплекса Гольджи. Это те элементы комплекса Гольджи, которые, перемещаясь внутри клетки, доставляют органические молекулы в места их потребления. Когда же эти везикулы сливаются с SCV, находящиеся внутри сальмонеллы получают питательные вещества, что позволяет им не только выживать, но и размножаться. Для такого перенаправления транспорта элементов комплекса Гольджи сальмонеллы выделяют еще два SPI-2 T3SS-эффектора – белки SseF и SseG. Вспомогательные роли в этом процессе перенастройки везикулярного внутриклеточного транспорта и в процессе образования комплексов из соединенных актиновыми нитями SCV играют еще несколько SPI-2 T3SS-эффекторов – белки SseF, SseG, PipB2 и SopD2, однако точки их приложения пока не изучены.
Конечный эффект суммарного действия всех SPI-2 T3SS-эффекторов на этом этапе инфекционного процесса – это выживание и размножение клеток патогена внутри клеток эпителия кишечника хозяина, что для сальмонелл является ключевым моментом.
Подобного уровня сведения о действии T3SS–эффекторов быстрыми темпами накапливаются в настоящее время для энтеропатогенных E.coli, для всех патогенных видов родов Yersinia, Shigella, Bordetella, Vibrio, Pseudomonas, Burkholderia, Clamidia и других. Таким образом, можно констатировать, что системы секреции типа III вносят существенный вклад во взаимодействие возбудителей болезней с их хозяевами.
Еще одной связанной с патогенезом секреторной системой является система типа IV (T4SS). По своему характеру эта система имеет сходство с системой типа III – она способна обеспечить доставку эффекторных молекул непосредственно в эукариотическую клетку. Назвать такую систему системой четвертого типа предложил G.P.C. Salmond в своем обзоре 1994 года (Secretion of extracellular virulence factors by plant pathogenic bacteria. Ann. Rev. Phytopathol. 32: 181-200), где он суммировал имевшиеся на то время сведения о функционировании системы переноса Т-ДНК из клеток агробактерий в растительную клетку. Гены, определяющие формирование и работу этой системы, локализованы в Ti-плазмидах Agrobacterium tumefaciens и составляют в ней так называемую Vir-область. При изучении этих генов и их продуктов (vir-белков A. tumefaciens) выяснилось, что они в высокой степени родственны белкам, которые у других видов бактерий обеспечивают перенос ДНК из донорской бактериальной клетки в реципиентную при конъюгации. Но поскольку эта система, вне всякого сомнения, имеет прямое отношение к развитию широко распространенного среди двудольных растений заболевания под названием корончатый галл, было предложено считать ее системой секреции факторов патогенности и вирулентности.
Первоначально считалось, что эта система секреции факторов патогенности характерна только для фитопатогенов. Однако к началу 2000-ых годов стало известно, что и у некоторых патогенов человека и других млекопитающих такая система может иметь отношение к патогенезу. В частности, Helicobacter pylori, вызывающий такие патологии, как язвенная болезнь и аденокарцинома желудка, использует родственную систему для доставки имеющего молекулярную массу 145kDa белка CagA в клетки хозяина. Под влиянием этого белка в клетках эпителия желудка начинаются перестройки цитоскелета, с их поверхности исчезают микроворсинки и клетки начинают продуцировать интелейкин-8. Кроме того показано, что Helicobacter pylori ингибирует фагоцитарную активность моноцитов и полиморфноядерных лейкоцитов. Этот антифагоцитарный фенотип также зависит от компонентов секреторной системы типа IV, а именно белков CagТ и НРО525, являющихся гомологами белков VirB7 и VirB11 A. tumefaciens соответственно.
Несколько патогенов, способных существовать в организме хозяина внутриклеточно, среди которых Legionella pneumophila, Brucella abortus, Brucella suis, Bartonella henselae (ранее называемая Rochalimaea henselae – возбудитель «болезни кошачьих царапин») и Rickettsia prowazekii, могут после их захвата фагоцитами вводить через стенку фагосомы в цитоплазму эукариотической клетки эффекторные белки, препятствующие слиянию лизосом с фагосомой. Установлено также, что вирулентность Campilobacter jejuni (возбудитель острых кишечных заболеваний, относимых к группе «диареи путешественников») поддерживается белками, гомологичными VirB-белкам бруцелл, так что этот микроорганизм, вероятно, добавляется к патогенам, использующим систему секреции типа IV.
Особый случай секреции факторов патогенности черезT4SS описан для вызывающего коклюш патогена Bordetella pertussis. Это пока единственный вид, для которого показано секреция эффектора (т.е. белка, дающего патологический эффект) через T4SS не в цитоплазму хозяйской клетки, а в межклеточное пространство. Конкретно, один из токсинов бордетелл (pertussis toxin) после транспорта системой типа IV, будучи типичным АВ-токсином с формулой АВ5, проникает в клетку слизистой оболочки трахеи самостоятельно путем связывания соответствующим рецептором на ее поверхности. Основанием для принятия такой схемы действия пертуссис-токсина является то, что девять генов ptl (p ertussis t oxin l iberation – освобождение пертуссис-токсина) Bordetella pertussis, от которых зависит его секреция, имеют высокою гомологию с virB-генами Agrobacterium tumefaciens. Эти гены расположены внепосредственной близости со структурными генами этого токсина, и мутации в ptl-генах приводят к отсутствию способности бордетелл вызывать поражение клеток, связанное с действием пертуссис-токсина.
Сведений о том, как именно транслоцируются через эту систему белки пока накоплено немного, поэтому ее описание дают применительно к переносу нуклеопротеиновых комплексов, в частности так называемого Т-комплекса, содержащего соответствующую Т-ДНК агробактерий однонитевую ДНК и белок VirD2. В классическом варианте эта система относится к sec-независимым (т.е. одноэтапным) и представляет собой собирающийся из более чем десяти различных белков канал, проходящий от внутренней мембраны бактерий через их клеточную стенку и далее через мембрану клетки хозяина (рис. 5).
Локализованные в цитоплазматической мембране белки VirВ4 и VirВ11 обладают АТФ-связывающей активностью и способностью взаимодействовать с секретируемыми субстратами. От них зависит избирательность и энергоснабжаемость системы в ходе ее функционирования.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 350; Нарушение авторских прав?; Мы поможем в написании вашей работы!