
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Секреция факторов патогенности 2 страница
|
|
|
|
Еще одна группа белков (VirВ7, VirВ9) имеет сродство к наружной мембране и одновременно является основой для закрепления белков VirВ2, условно называемых пилинами, из которых формируется полый пилюс, контактирующий с цитоплазматической мембраной эукариотической клетки. Белок VirВ7 интегрирован в наружную мембрану, а белки VirВ9 и VirВ10, присоединяясь своими С-концевыми частями к наружной мембране (outer membrane) изнутри, образуют так называемый О-слой (О-layer) основного тела (main body). N-концевые участки этих же белков образуют I-слой (от англ. i nner membrane) основного тела, соприкасающийся с цитоплазматической мембраной. Количество входящих в основное тело молекул каждого из этих белков определено как 14, и они накладываются друг на друга, образуя двойные стенки.

Рис.5. Структура секреторного аппарата T4SS. IM – внутренняя мембрана, OM – наружная мембрана. Цифровые и буквенные обозначения на изображениях белков соответствуют Vir-белкам (В4 – белок VirВ4 и т.д.). CT и NT обозначают С-концевую и N-концевую части белков соответственно.
Располагающийся с цитоплазматической стороны внутренней мембраны белок VirD4 совместно с направленными в сторону периплазмы белками VirВ6 и VirВ8 обеспечивают правильную ориентацию секретируемых белков и нуклеопротеиновых комплексов.
Считается, что взаимодействие построенного из белка VirВ2 пилюса с мембраной клеток хозяина обеспечивается также белками самой секреторной системы, которые проходят через уже сформированную часть канала перед началом транспорта собственно пилинов, диффундируют через межклеточное пространство и закрепляются на мембране эукариотической клетки. Таким путем формируется место контакта далее строящегося пилюса и, предположительно, создаются условия для проникновения его через мембрану.
|
|
|
Хотя такая схема установления контакта еще не полностью подтверждена экспериментально, ей отдается явное предпочтение, поскольку, исходя из нее, достаточно легко объясняется широкий круг хозяев агробактерий и широкое распространение конъюгационных взаимоотношений между различными представителями грамотрицательных бактерий. Действительно, обладающие такой системой A grobacterium tumefaciens способны вызывать развитие опухоли практически у всех видов растений из класса Двудольные, а несущие плазмиды широкого круга хозяев бактерии E. coli конъюгируют с реципиентами из практически всех видов грамотрицательных микроорганизмов. Здесь следует еще раз подчеркнуть тесное родство и, очевидно, общее эволюционное происхождение системы секреции факторов патогенности типа IV и надмолекулярных структур, называемых комплексы формирования пар скрещивания (the mating pair formation complex) - сокращенно Mpf-комплексы. Эти структуры образуются в клетках-донорах при наличии у них соответствующих tra-оперонов и представляют собой конъюгационный пилюс, обеспечивающий контакт с реципиентной клеткой и формирующий канал, через который передается одна нить ДНК при конъюгации.
Исходя из сведений, накапливающихся в последнее десятилетие, можно предполагать, что у некоторых патогенов такие системы модифицировались именно для экспорта белков, а не нуклеопротеиновых комплексов и уже существуют и функционируют под контролем регуляторных генов патогенеза, причем наряду с собственно системами конъюгационного переноса.
Система секреции типа V (T5SS) называемая также системой автотранспортеров первоначально описана у Neisseria gonorrhoeae при изучении осуществляемой ими продукции IgA1-протеазы, но затем было показано ее причастность к секреции целого ряда имеющих отношение к патогенности и вирулентности белков, в частности адгезинов. В этой системе С-концевая последовательность самого белка определяет экспорт N-терминального домена через наружную мембрану, что и послужило основанием для наименования этой системы.
|
|
|
Большинство автотранспортеров несет N-концевую сигнальную последовательность, разрешающую выход в периплазматическое пространство с использованием Sec-машины, работающей, как описано выше (стр. 95), в системе секреции типа II. Причем большинство сигнальных последовательностей у автотранспортеров необычно длинные, что может отражать необходимость некоторых дополнительных требований для транспорта этих белков через внутреннюю мембрану. N-концевая сигнальная последовательность примыкает к домену α, за которым следует С-концевой домен β. Последний имеет характеристики белков наружной мембраны и предназначен для формирования пронизывающей мембрану бочкообразной (barrel) структуры, стенки которой состоят из 10-14 петель полипептидной цепи β-домена, находящейся не в α-, а в β-конфигурации (вторичной структуре). Такой, условно говоря, бочонок не имеет дна и крышки, и через него перемещается домен α, называемый также «домен-пассажир». Эта сформированная β-доменом пора по расчетам должна быть узкой, поэтому предполагается, что α-домен проталкивается как близкая к линейной структура. В соответствии с этим было показано, что введение в район α-домена дисульфидных мостиков ингибирует секрецию. Не решенным вопросом остается как этот домен, будучи, фактически, только во вторичной структуре, сохраняет эту структуру и при этом не подвергается действию протеаз в течение контакта с наружной мембраной и при перемещении через нее. Возможно, что периплазматические шапероны играют здесь какую-то роль или же что часть самого белка играет роль внутримолекулярного шаперона. Противоположные гипотезы предполагают, что транспорт через внутреннюю и внешнюю мембраны может быть объединенным процессом. В этом отношении необычно длинный секреторный сигнал может играть определенную роль.
До сих пор остается невыясненным вопрос, в любое ли место наружной мембраны может встраиваться β-домен секретируемых по типу V белков. Многие авторы считают, что в этой системе должны работать специальные белки, предварительно встраивающиеся в наружную мембрану и тем самым определяющие место образования β-бочонка. На роль такого белка претендует протеин Omp85/YaeT, который имеется у многих видов бактерий, а также в мембранах митохондрий и пластид эукариот. Однако прямых доказательств участия Omp85/YaeT в интеграции β-доменов секретируемых по типу V белков пока не получено.
|
|
|
После выхода на наружную поверхность клетки судьба “пассажиров” оказывается различной в зависимости от того, что секретируется. Два домена могут оставаться ковалентно или нековалентно связанными или же α-домен может протеолитически отщепляться и функционировать самостоятельно уже во внеклеточном пространстве. Отщепление может происходить как автокаталитически, так и, в некоторых случаях, с участием локализуемых во внешней мембране протеаз.
В том случае, когда домен-пассажир остается ковалентно связанным с β-доменом, он играет в большинстве случаев роль адгезина, то есть фактора патогенности, обеспечивающего прикрепление к тканям организма-хозяина. В частности, адгезины Escherichia coli AIDA-I и Ag43, адгезин YadA Yersinia enterocolitica и Yersinia pseudotuberculosis, адгезин Hia Haemophilus influenzae, адгезин Prn Bordetella pertussis являются типичными белками-аутотранспортерами.
Для освободившихся α-доменов прежде всего установлена роль протеаз. Кроме уже упоминавшейся IgA1-протеазы Neisseria gonorrheae и Neisseria meningitidis показано участие в патогенезе ряда сериновых протеаз энтеробактерий. Они даже получили собственное название, чаще всего используемое в виде аббревиатуры – SPATE (от англ. the s erine p rotease a uto t ransporters of E nterobacteriaceae). Эти протеазы относятся к группе цитотоксинов типа V (см. стр. 82) и их примерами являются протеолитический токсин Pet и геамагглютинирующий/гемоглобинсвязывающий токсин Tsh/Hbp штаммов Escherichia coli,вызывающих «диарею путешественников», диарею детей первого года жизни и персистентную диарею у ВИЧ-инфицированных. Сюда же попадают токсин SepA Shigella flexneri, токсин PrtS клинических штаммов Serratia marcescens, протеазы- муциназы Pic и SepA различных видов шигелл. Из не относящихся к энтеробактериям патогенов, способных секретировать протеазы по пути секреции V можно назвать Haemophilus influenzae (Hap-белок) и Bordetella pertussis (протеаза SphB1 проидающий резистентность к комплементу белок BrkA). Кроме того, белками-аутотранспортерами являются эстераза EstA Pseudomonas aeruginosa и токсин VacA Helicobacter pylori.
|
|
|
Следует отметить, что все эти белки имеют достаточно большие молекулярные массы, превышающие массы тех белков, которые секретируются через системы типа I и типа II. Существует мнение, что систему типа V следует рассматривать как специализированную для транспорта крупных белков, поэтому в обзорах последних лет в эту систему включают и рассматриваемую ранее отдельно так называемую двупартнерную систему секреции или в английской аббревиатуре TPS (от the t wo- p artner s ecretion). Основанием для этого служит следующее.
В TPS-системе секретируемый белок, обозначаемый TpsА, переносится в периплазматическое пространство с помощью Sec-машины независимо от второго партнера – белка TpsВ, для чего у каждого из этих белков на N-концах имеются соответствующие сигнальные последовательности. Белки TpsВ имеют пространственную структуру, очень похожую на β-домен белков-аутотранспортеров, и после встраивания в наружную мембрану образуют пору-бочонок из 10-12 петель с β-структурой, через которую и секретируется белок TpsА. То есть фактически основное отличие от типичной системы секреции типа V заключается в том, что, условно говоря, α- и β-домены разобщены, но при секреции кодирующие их гены всегда экспрессируются совместно и для каждого TpsА есть свой TpsВ.
Примерами секретируемых таким путем факторов патогенности являются цитолизин ShlA Serratia marcescens (соответствующий ему TpsВ называется ShlB), цитолизин EthA Edwardsiella tarda (TpsВ – EthB), адгезины HMW1 и HMW2 Haemophilus influenza e, (TpsВ - HMW1В и HMW2B соответственно), адгезины LspA1 и LspA2 Haemophilus ducreyi (TpsВ - LspB1и LspB2 соответственно), филаментозный гемагглютинин FHA Bordetella pertussis (TpsВ – FhaC). Все эти белки имеют большие молекулярные массы и состоят не менее чем из 3000 аминокислотных остатков. Наибольший из секретируемых таким путем белков обнаружен при протеомном анализе Pseudomonas aeruginosa PAO1 - его масса составляет 361 594 Da, а количество аминокислотных остатков - 5 627.
Система секреции типа VI (T6SS) описано недавно. В начале 2000-х годов при анализе сиквенсов островов патогенности возбудителей различных болезней было зафиксировано консервативное семейство генов, функции которых на тот момент были не ясны. Но к 2006 году удалось установить, что продукты этих генов формируют специализированную секреторную систему, функционально сходную с системами типа III и IV - система обеспечивает доставку секретируемого белка непосредственно в цитоплазму хозяйских клеток.
Согласно данным, полученным при анализе нуклеотидных последовательностей патогенов человека и животных, около четверти возбудителей обладают такой системой. В основном это представители отдела Proteobacteria, в частности Vibrio cholerae, Edwardsiella tarda, Pseudomonas aeruginosa, Francisella tularensis и Burkholderia mallei, но кроме этого сходные группы генов обнаружены у почвенных и водных бактерий из пока еще плохо изученных отделов Planctomycetes и Acidobacteria. Предполагается, что у непатогенных бактерий T6SS может иметь отношение к образованию биопленок, и патогены могли получить кодирующую эту систему гены в результате горизонтального переноса генетической информации.
Количество генов, входящих в T6SS-кластеры, колеблется от 15 до 25, и пока еще не все продукты этих генов охарактеризованы структурно и функционально. Из хорошо охарактеризованных и имеющих отношение к структурной части системы типа VI можно привести белок Hcp (от англ. h emolysin c oregulated p rotein) и белок VgrG (от англ. v aline– g lycine r epeat protein G), описанные для энтеропатогенного штамма E. coli O157: H7. Гомологи этих белков или кодирующие их гены у других видов бактерий могут иметь иные названия, но их наличие считается критерием присутствия у данных бактерий T6SS.
В экспериментах с выделенным и очищенным белком Hcp было установлено, что он способен образовывать кольцевые олигомеры из шести молекул, которые затем объединяются в трубочки с внутренним диаметром 40 ангстрем и длиной около 100 нанометров.
Белок VgrG имеет ярко выраженное структурное сходство с белками бактериофага Т4, которые формируют так называемую «иглу» (the needle complex) на конце хвостового отростка. С помощью этого комплекса бактериофаг прокалывает мембрану и вводит свою ДНК в цитоплазму бактериальной клетки. В образующих «иглу» белках gp27 и gp5 бактериофага имеются характерные β-спиральные участки в С-концевом домене, от которых зависит их способность проходить через мембрану. Именно такие участки обнаружены в белке VgrG и его аналогов у других бактерий. Кроме того, белки бактериофага образуют комплексы из трех молекул (тримеры), которые затем и собираются в «иглу». Белок VgrG также спонтанно образует триммер.
Эти данные послужили основой для создания предположительной модели действия T6SS (рис. 6).
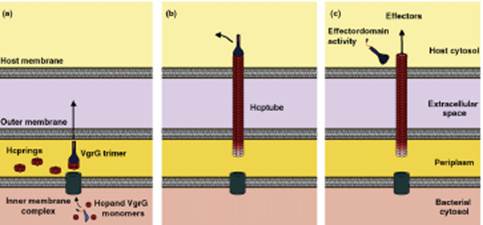
Рис. 6. Схема сборки и функционирования T6SS (пояснения приведены в основном тексте).
Согласно приведенной схеме на этапе (a) в результате активации генов кластера T6SS в цитоплазме бактериальной клетки появляются мономеры белков Hcp и VgrG, которые с помощью еще не охарактеризованного комплекса белков во внутренней мембране (inner membrane complex) перемещаются в периплазматическое пространство. Здесь из мономеров Hcp формируются гексамерные кольца (hexameric rings), а из мономеров VgrG – тример (VgrG trimer). Тример VgrG объединяется с одним из гексамеров Hcp, и затем снизу к этому гексамеру последовательно присоединяются новые гексамерные кольца. С этого момента начинается этап (b), в ходе которого удлиняющаяся полая структура из молекул Hcp (Hcp tube) с тримером из молекул VgrG на конце проходит через клеточную стенку, наружную мембрану и растет до соприкосновения с мембраной эукариотической клетки (host membrane). Тример VgrG проделывает в мембране отверстие, и растущая трубка входит в цитоплазму эукариотической клетки (host cytosol). На этапе (c) на молекулах VgrG обнажается активный С-концевой домен, который может взаимодействовать с какими-либо мишенями в эукариотической клетке. В частности, для белка VgrG Vibrio cholerae показана актинсвязывающая активность, и предполагается, что тример VgrG отделяется от конца трубки, тем самым освобождая проход для передаваемых из бактериальной клетки T6SS-эффекторов, но сам при этом тоже действует как эффектор – повреждает цитоскелет клетки, перекрестно связывая актиновые нити (effector-domain activity).
Описанная модель действия T6SS, конечно же, далека от совершенства, но в ходе дальнейшего изучения роли этой системы секреции в определении патогенных свойств бактерий она несомненно будет корректироваться и уточняться.
Последней из систем секреции, которая уже получила цифровое наименование, является система секреции типа VII (T7SS). Ее существование было предсказано в конце 1990-х годов при анализе полной последовательности генома типового штамма возбудителя туберкулеза Mycobacterium tuberculosis H37 Rv, и далее подтверждено в ходе экспериментальной работы с другими штаммами Mycobacterium tuberculosis и другими видами рода Mycobacterium – M. bovis, M. avium, M.marinum.
Особенностью всех микобактерий является необычное строение их клеточных стенок. По химическому составу и архитектуре расположенных над цитоплазматической мембраной слоев эти бактерии ближе к грамположительным – у них отсутствует периплазматическое пространство, имеется примыкающий к мембране пептидогликановый слой, но не имеется характерной для грамотрицательных бактерий наружной липопротеиновой мембраны. Однако, в отличие от типичных грамположительных бактерий, у относящихся к отделу Actinobacteria микобактерий в клеточной стенке муреиновые комплексы чередуются с комплексами из арабиногалактана, к которым присоединены молекулы миколовых кислот. Эти кислоты представляют собой особо длинные (количество атомов углерода в пределах 70 – 90) и разветвленные (боковые цепи содержат до 24 атомов углерода) жирные кислоты, и плотность их расположения такова, что из них формируется слой толщиной 8-10 нанометров. Как и положено жирным кислотам, они не растворимы в воде, к тому же между ними располагаются молекулы так называемых свободных гликолипидов сложного состава (фтиоцеролдимикокерозаты, фосфотидилинозитолманнозиты, сульфолипиды, димикотрегалоза, она же корд-фактор, и др.), которые еще больше повышают гидрофобность этого слоя. В связи с этим эту часть клеточной стенки называют микомембраной.
Наличие микомембраны коррелирует с относительно малым количеством секретируемых в окружающую среду белков, причем у тех, которые секретируются, отсутствуют сигнальные последовательности, характерные для белков, транспортируемых через системы секреции типов I – VI. Поэтому, когда геномный анализ показал наличие у микобактерий около 10% процентов генов¸ кодирующих белки необычного аминокислотного состава, встал вопрос о роли этих белков в жизнедеятельности и патогенности возбудителей туберкулеза.
Такие белки отличаются наличием повторяющихся сочетаний либо остатков пролина и глютаминовой кислоты, из-за чего в английской аббревиатуре их называют РЕ-белки (Е – обозначение глютаминовой кислоты в однобуквенной системе)¸ либо пролина, пролина, и глютаминовой кислоты (соответственно эти белки называются РРЕ). Кодирующие эти белки гены в геноме микобактерий чаще всего образуют кластеры с генами, которые кодируют мембранассоциированные белки и белки с АТФазной активностью, обычно участвующие у других бактерий в секреции. Это позволило предположить, что такие кластеры кодируют белки систем секреции и их стали называть ESX. Название было дано как аббревиатура от английской фразы ESAT-6 secretion system Х, поскольку структура собственно системы секреции еще была неизвестна. Белок же ESAT-6 уже был известен как один из факторов патогенности микобактерий, и его название происходит от фразы early secreted antigenic target of 6 kDa – рано активируемая антигенная мишень с массой 6 кД. Реально этот белок вызывает образование пор в мембране эритроцитов и приводит их к гибели, а также обеспечивает выход микобактерий из фагосомы в цитоплазму фагоцитов на стадии внутриклеточного существования. Вспомогательным белком для ESAT-6 является белок CFP-10 (от англ. culture filtrate protein of 10 kDa – белок культуральной жидкости с массой 10 кД). Ген, который кодирует CFP-10, находится в одном опероне с геном, кодирующим ESAT-6, и они экспрессируются совместно. Оба эти белка относятся к семейству РРЕ.
Дальнейшее изучение геномов микобактерий показало, что у разных видов микобактерий соответствующие ESX кластеры генов могут повторяться до 5 раз, сочетаясь с генами различных белков из семейств РЕ и РРЕ. Тогда первое открытое сочетание генов секреции и генов секретируемых белков стали называть ESX-1, а остальные соответственно получали названия от ESX-2 до ESX-5. В 2007 году было предложено все эти варианты относить к типу секреции VII.
Существенно, что количество ESX-систем достаточно хорошо коррелирует с уровнем патогенности микобактерий. Самые патогенные виды рода Mycobacterium (так называемые медленно растущие M.avium, M.bovis, M.marinum, M.tuberculosis, M.leprae)имеют в своем геноме все пять ESX. Быстрорастущие и менее патогенные M.smegmatis и M.gilvum имеют только три таких кластера.
Еще одним свидетельством причастности системы секреции типа VII к патогенным свойствам является отсутствие у вакцинного штамма BCG (бацилла Кельмета-Герена, широко применяемая для профилактики туберкулеза живая вакцина) одного из кластеров (ESX-1). Получилось так, что еще в впервой половине 20-го века эмпирически удалось отобрать штамм с делецией части хромосомы, которая сделала его не вирулентным, но оставила высоко иммуногенным. Это еще раз подтверждает, что только совокупность всех пяти вариантов ESX-систем делают штаммы высокопатогенными.
Механизм действия и строение секреторного аппарата типа VII изучены пока мало, но в общих чертах на примере секреции комплекса ESAT-6--CFP-10предполагается следующая схема (рис.7).

Рис.7. Предположительная схема работы системы секреции типа VII. ММ – микомебрана клеточной стенки Mycobacterium tuberculosis. IМ – цитоплазматическая мембрана Mycobacterium tuberculosis. Остальные пояснения приводятся в основном тексте.
Белок ESAT-6 после синтеза на рибосомах объединяется с цитоплазматическим белком-шапероном CFP-10, образуя пригодный для секреции гетеродимерный комплекс ESAT-6--CFP-10. Этот комплекс распознается белком Rv3871, который присоединяется к С-концевому участку белка CFP-10. Далее белок Rv3871 связывается с локализованным в цитоплазматической мембране белком Rv3870, образуя активную АТФазу, которая предположительно должна снабжать процесс секреции энергией.
К этому времени в цитоплазматической мембране уже должен быть сформирована пора из белка Rv3877 (этот белок выбрали для такой роли из-за того, что он имеет 11 трансмембранных доменов), в который и направляется секретируемый комплекс. Одновременно с этим комплексом по пока еще не определенной схеме к каналу направляется белок Rv3616с (его второе название EspA), поскольку экспериментально установлено, что EspA и комплекс ESAT-6--CFP-10 всегда секретируются совместно, хотя во внешней среде обнаруживаются как отдельные частицы.
Из каких белков строится проходящий через микомембрану канал и как он соединяется с порой во внутренней мембране, пока не установлено. Не определена и роль белка Rv3868, который по своей аминокислотной последовательности должен быть ААА+ - белком (от англ. A TPases A ssociated with diverse cellular A ctivities – так называют АТФазы, участвующие в очень различных внутриклеточных процессах как в клетках прокариот, так и в клетках эукариот), но предполагается, что он должен снабжать энергией процесс сборки секреторного аппарата.
В отношении функций показанных на рис. 7 других свободных цитоплазматических белков и белков, интегрированных в мембрану, сведений пока нет, но их отсутствие сказывается на секреции EspA и комплекса ESAT-6--CFP-10.
К настоящему времени гены, гомологичные ESX-генам микобактерий, обнаружены у некоторых грамположительных микроорганизмов, в частности, у Corynebacterium diphtheria, Staphylococcus aureus, Streptococcus agalactiae, Bacillus subtilis, Listeria monocytogenes, Streptomyces coelicolor. Это позволяет некоторым авторам утверждать, что первоначально считавшаяся чисто микобактериальной система секреции типа VII, должна рассматриваться как общая секреторная система для грамположительных бактерий из отделов Actinobacteria и Firmicutes.
Еще одной важной для патогенеза системой секреции является специализированная система для построения фимбрий и пилюсов различного назначения на поверхности клеток грамотрицательных бактерий. Она не получила цифрового наименования и называется CU секреционный путь (chaperone/usher secretion pathway или chaperone/usher machinery). В русскоязычном изложении это может звучать как секреция, опосредованная взаимодействием шаперонов и «швейцаров». Из возможных вариантов перевода словаusher слово «швейцар» кажется наиболее приемлемым, исходя из той роли, которую исполняют локализованные в наружной мембране молекулы.
Образуемые с помощью такой системы пилюсы и фимбрии наиболее выражены у представителей класса Gamma- Proteobacteria и используются патогенными бактериями в основном для прикрепления к клеткам хозяина на первых стадиях его колонизации. В частности, для патогенных энтеробактерий (энтеропатогенных эшерихий, сальмонелл, йерсиний, протеев) так называемые фимбриальные адгезины являются основными факторами вирулентности и при их отсутствии инфекционный процесс фактически не развивается. У Yersinia pestis имеются особого строения фимбрии, образующиеся на поверхности клетки в большом количестве и формирующие своеобразную «шубу», защищающую такие клетки от фагоцитоза. У многих бактерий такие пилюсы и фимбрии задействованы в формировании биопленок на твердых поверхностях и микроколоний при существовании в жидкой среде. Показано также, что собственно белки пилей и фимбрий, вводимые в чистом виде в организм лабораторных животных, вызывают мощные воспалительные процессы и развитие иммунных ответов на присущие им антигеннные детерминанты. Это позволяет рассматривать их как самостоятельные факторы вирулентности, действующие не только на этапах адгезии и колонизации, но и на более поздних стадиях инфекционного процесса.
Морфологически собираемые с помощью CU-системы структуры делятся на две группы. Это могут быть короткие, достаточно жесткие, палочковидные структуры, состоящие из субъединиц одного (реже двух) типов, количество которых обычно более 1000. Диаметр таких пилюсов 7-8 нанометров, а длина около 2 микрометров. На верхнем конце таких пилюсов имеются более узкий (около 2 нанометров) гибкий кончик длиной около 40 нанометров, который и определяет адгезивные свойства. Такое строение имеют так называемые Р-пилюсы энтеробактерий. К этой же структурной группе CU-пилюсов относят пилюсы типа 1 энтеропатогенных эшерихий. Они несколько тоньше и короче, чем Р-пилюсы, и имеют более короткий (10-19 нанометров) гибкий кончик.
Вторую морфологическую группу CU-пилюсов составляют типичные гибкие фимбрии, по диаметру сопоставимые с концевыми отростками Р-пилюсов и пилюсов типа 1. Это изначально гибкие состоящие приблизительно из 1000 одинаковых субъединиц структуры, которые могут переплетаться и соединяться друг с другом, образуя подобие капсулы или «шубу» на поверхности бактериальной клетки. Такое строение характерно для фимбрий, формирующих так называемую F1-капсулу у Yersinia pestis.
Структурные гены белков-пилинов, необходимых для формирования такой конкретной поверхностной структуры, обычно располагаются в одном кластере с генами, кодирующими белки соответствующего секреционного аппарата – шапероны и белки- швейцары (ushers). Активность этих генов регулируется координировано, что и обеспечивает быстрое образование необходимых пилюсов и фимбрий после получения бактериальной клеткой определенного сигнала.
Несмотря на отличия конкретных шаперонов и швейцаров по специфичности, они сохраняют общий характерный способ функционирования, поэтому можно рассмотреть действие CU-системы на примере обобщенной схемы.
Эту систему следует отнести к двухэтапным или Sec-зависимым (рис.8). Молекулы белков-пилинов по мере их синтеза на рибосомах

Рис. 8. Схема работы CU секреционного пути. ОМ - наружная мембрана, IM – цитоплазматическая мембрана, А1-А5 – белковые субъединицы пилюса, С1-С3 – периплазматические шапероны, U1 и U2 – две молекулы-швейцары, N1и N2 – N-концевые домены двух различных молекул-швейцаров, P – вильчатый домен швейцара 2, P’и P” – два возможных положения вильчатого домена швейцара 1. Стрелки и цифры обозначают происходящие в периплазме этапы функционирования системы и направления перемещения молекул в ходе них.
направляются к цитоплазматической мембране и с помощью секреторной машины (SecYEG) выводятся в периплазматическое пространство. В периплазме к это времени уже находятся специфические периплазматические шапероны, структура которых позволяет быстро присоединять к себе соответствующий пилин. Два домена в таком шапероне расположены в пространстве так, чтобы между ними могла поместиться молекула пилина, а специальная петля на N-концевом домене пилина попала в определенное место на стыке двух доменов шаперона. Такой характер связывания пилина с шапероном предотвращает преждевременный фолдинг пилина, защищает его от разрушения периплазматическими протеазами и одновременно обеспечивает возможность контакта на следующем этапе с такой же молекулой пилина в основании строящегося пилюса или фимбрии. Заканчивается первый этап перемещением такого комплекса пилин-шаперон к уже сформировавшемуся в наружной мембране сочетанию двух молекул-швейцаров. Каждая встроенная в мембрану молекула-швейцар устроена таким образом, что ее С-концевой участок образует пору в мембране, а N-концевой домен свободно перемещается с внутренней стороны наружной мембраны.
На втором этапе свободный N-концевой домен одного из швейцаров связывается с шапероном этого комплекса и перемещает комплекс к основанию строящегося пилюса. При этом уже находящийся здесь ранее пришедший комплекс пилин-шаперон распадается: имеющийся в нем пилин остается связанным со швейцаром, а шаперон освобождается (на схеме это этап 4). Подходящий в этот момент комплекс занимает его место, новая молекула пилина оказывается рядом с уже прикрепленной и соединяется с ней. В это время новый комплекс пилин-шаперон с помощью N-концевого домена второго шаперона перемещается сюда же, предшествующий комплекс распадается, пилин из него присоединяется к основанию растущего пилюса, а шаперон уходит для связывания новой молекулы пилина. Таким образом, действуя попеременно, молекулы-швейцары наращивают пилюс от основания до полного его построения и проталкивают нарастающую структуру через пору одного из швейцаров. Суммируя роль швейцаров, можно сказать, что они являются своеобразной платформой для сборки, закрепления в мембране и перемещения строящегося пилюса на наружную поверхность, проявляя тем самым и структурную, и каталитическую, и динамическую (двигательную) активность.
Заканчивая рассмотрение систем секреции факторов патогенности и вирулентности, надо отметить их многообразие и одновременно широкую распространенность некоторых из них среди бактерий различных систематических групп. Важно также и то, что многие патогенные бактерии имеют целый набор различных систем секреции и используют их в различные этапы своих жизненных циклов. Детальное изучение уже известных систем, и поиск новых интенсивно продолжаются и являются в настоящее время одними из приоритетнейших направлений современной медицинской микробиологии. Полученные в ходе таких исследований знания ложатся в основу методов профилактики и терапии инфекционных заболеваний.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 618; Нарушение авторских прав?; Мы поможем в написании вашей работы!