
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Для константы скорости бимолекулярной реакции получаем
|
|
|
|
k11 (ТАС) = N A 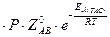 , (35)
, (35)
где 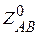 - число двойных столкновений в 1 см3 при nA = nB = 1 молекул∙см-3,
- число двойных столкновений в 1 см3 при nA = nB = 1 молекул∙см-3,
NA - число Авогадро.
Полученное уравнение - это основное уравнение ТАС для константы скорости бимолекулярной реакции. Сравнение этого уравнения с уравнением Аррениуса позволяет определить связь истинной (т.е. рассматриваемой в ТАС) и аррениусовской энергией активации, которая выражается соотношением
ЕА(ТАС) = ЕА(Ар) - 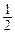 RT (36)
RT (36)
Теория активированного комплекса. Процесс взаимодействие атома А с двухатомной молекулой ВС формально можно представить проходящим через промежуточное состояние системы [ А... В... С ]¹ (активированный комплекс), как это изображено на рис.15.
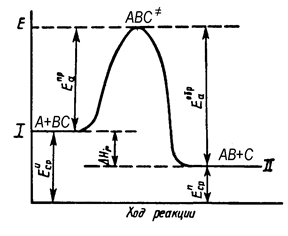
| Рис.15. Изменение энергии в ходе экзотемической реакции |
Согласно основному постулату ТАК исходные вещества всегда находятся в равновесии с активированным комплексом, и схема бимолекулярной реакции выглядит следующим образом
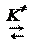 А + ВС [ А... В... С ]¹
А + ВС [ А... В... С ]¹  АВ + С, (37)
АВ + С, (37)
где К ¹- константа равновесия реакции образования активированного комплекса.
В теории активированного комплекса показано, что константа скорости бимолекулярной реакции k связана с К ¹ соотношением:
 , (38)
, (38)
где c - трансмиссионный коэффициент, учитывающий возможность распада комплекса с образованием исходных частиц ( [АВС]¹ ® А + ВС ).
Для большинства реакций c = 1. Таким образом, для расчета k необходимо знать К¹, которую в ряде простых случаев можно рассчитать на основании значений энергий связи и геометрии молекул методами статистической термодинамики.
Фотохимические реакции - это реакции, происходящие под действием светового излучения (обычно видимого или УФ излучения) Энергия одного кванта света связана с длиной волны соотношением
Е = hv (39)
где v – частота излучения,
h – постоянная Планка, равна 6,626∙10-34Дж∙с.
При поглощении света происходит первичная реакция (фотохимическая активация) и молекула переходит в возбуждённое состояние. Возбуждённая молекула может испытывать последующие превращения (вторичные реакции):
1) флуоресценция – быстрое испускание света и переход в исходное электронное состояние;
2) фосфоресценция – испускание света с некоторой задержкой по времени, которая необходима для того, чтобы молекула за счёт безызлучательных процессов перешла в другое возбуждённое состояние;
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1018; Нарушение авторских прав?; Мы поможем в написании вашей работы!