
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм такой реакции можно представить схемой
|
|
|
|
Механизм действия катализаторов связан с тем, что они образуют промежуточные соединения с исходными реагентами, изменяя тем самым путь реакции и уменьшая энергию активации.
Изменение температуры или интенсивное перемешивание могут перевести реакцию из одной области в другую.
I — кинетическая, II — диффузионная, III — переходная области.
1) Кинетическая область — если скорость диффузии значительно превышает скорость собственно химической реакции. Энергия активации реакции, протекающей в этой области, будет составлять более 60 кДж∙моль-1 (что характерно для химических реакций). В кинетической области концентрации реагирующего вещества в объеме и на поверхности раздела фаз мало отличаются и практически постоянны.
2) Диффузионная область — скорость собственно химической реакции значительно превышает скорость диффузии и все подведенное к поверхности раздела фаз вещество практически сразу превращается в продукт реакции. Энергия активации в этой области невелика и составляет менее 10 кДж∙моль-1, что соответствует энергии активации процесса диффузии.
3) Переходная область — скорости диффузии и химической реакции соизмеримы между собой. Опытная энергия активации здесь более 10 кДж∙моль-1 и увеличивается при понижении температуры.
Основные положения теории катализа. Под катализом понимают процесс изменения скорости химической реакции под действием особых веществ (катализаторов), многократно взаимодействующих с молекулами исходных реагентов с образованием промежуточных продуктов и не расходующихся в реакциях (катализаторы вступают в реакцию на промежуточных этапах и полностью регенерируются по завершении реакции в неизменном виде).
Частным случаем катализа является автокатализ, при котором свойствами катализатора обладает промежуточное соединение или продукты реакции.
Различают гомогенный и гетерогенный катализ. При гомогенном катализе все реагирующие вещества и катализатор находятся в одной фазе, при гетерогенном — катализатор составляет отдельную, обычно твердую, фазу.
На рис.17 представлено уменьшение энергии активации каталитической бимолекулярной реакции по сравнению с некаталитической
DE = E0 - E1 (40)
а) А + К 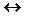 АК ¹
АК ¹
б) АК¹ 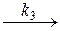 В + К
В + К
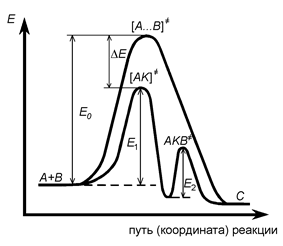
Рис.17. Изменение потенциальной энергии в гомогенной каталитической и некаталитической реакциях.
Исключительное значение в гомогенном катализе занимает ферментативный катализ - основа жизнедеятельности животных и растений.
Ферменты состоят либо целиком, либо в основном из белков. Каталитической активностью обладает не вся молекула фермента, а лишь определенный ее участок, называемый активным центром. Активный центр соединяется с молекулой реагирующего вещества, образуя непрочное промежуточное соединение, способное к дальнейшим превращениям. При этом активный центр вступает в соединение только с теми молекулами, структура которых подобна структуре активного центра. Этим, по-видимому, объясняется специфичность действия ферментов.
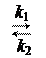 Для описания кинетики ферментативных реакций используют уравнение Михаэлиса-Ментен. Реакция с одним исходным веществом (субстратом) S, которое превращается в продукт P в присутствии катализатора Е (таким катализатором может быть фермент) описывается схемой
Для описания кинетики ферментативных реакций используют уравнение Михаэлиса-Ментен. Реакция с одним исходным веществом (субстратом) S, которое превращается в продукт P в присутствии катализатора Е (таким катализатором может быть фермент) описывается схемой
E + S ES  E+P
E+P
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 422; Нарушение авторских прав?; Мы поможем в написании вашей работы!