
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В этом случае
|
|
|
|
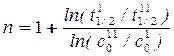 (17)
(17)
Возможен графический вариант метода: по оси ординат откладываются значения ln(t1/2), а по оси абсцисс - значения lnC0. Тогда n = - tga + 1.
4) Дифференциальный метод Вант-Гоффа.
Прологарифмируем уравнение 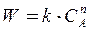 .
.
lnW = lnk + n lnС 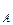 (18)
(18)
Очевидно, что в координатах lnW - lnC мы получим линейную зависимость, причем n = tga (рис. 11)
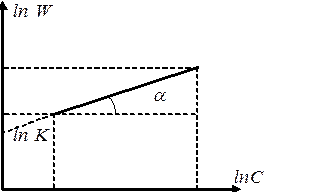
Рис.11. Определение порядка реакции дифференциальным методом Вант-Гоффа.
Кинетика сложных реакций. Сложными являются такие реакции, при которых в системе одновременно протекают как минимум две реакции с участием тех же реагирующих веществ.
1) Обратимые реакции

где k1 -константа скорости прямой реакции,
k2 - константа скорости обратной реакции.
Особенностью обратимых реакций является тот факт, что они протекают до установления состояния равновесия, при котором скорости прямой и обратной реакций равны. Такое состояние наступает при  ; в этот момент времени
; в этот момент времени 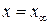 .
.
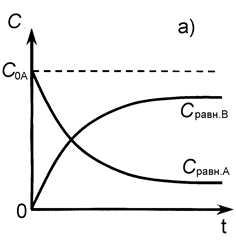
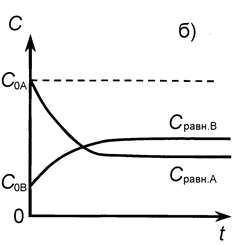
Рис.12. Зависимость концентраций реагента и продукта от времени для обратимой реакции первого порядка: а) С 0В = 0, б) С 0В ¹ 0.
Согласно закону действующих масс, константа равновесия КС может быть представлена как
КС = 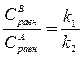 (19)
(19)
С учетом принципа независимости химических реакций (если в системе одновременно протекает несколько реакций, то они протекают независимо друг от друга и для каждой из них справедлив основной постулат химической кинетики) для скорости можно записать
 , (20)
, (20)
где b - начальная, концентрация вещества В,
(b-x) - текущая концентрация вещества В.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 477; Нарушение авторских прав?; Мы поможем в написании вашей работы!