
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Истинная (мгновенная) скорость реакции определяется соотношением
|
|
|
|
КИНЕТИКА И КАТАЛИЗ
Поскольку источником энергии элемента является потенциальная энергия, то ЭДС гравитационной цепи равна
E = MHg×g×  (20)
(20)
Химическая кинетика представляет собой раздел физической химии, изучающий механизмы химических реакций и закономерности их протекания во времени.
Скорость химической реакции (W) - это изменение количества вещества, вступающего в реакцию (или образующегося в результате реакции) в единице объема в единицу времени.
W = 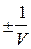
 , (1)
, (1)
где n - число молей или молекул вещества,
V - объем системы,
t - время.
Если система замкнута и ее объем постоянен, то
W = 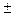
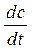 , (2)
, (2)
где С - концентрация вещества.
Скорость реакции всегда положительна. Размерность скорости - моль·л−1∙с-1; молекула см−3∙с-1 и т.д.
Основной постулат химической кинетики определяет, что при постоянной температуре скорость химической реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени
W = k× C1b× C2b× C3f¼, (3)
где k - константа скорости химической реакции, которая зависит от температуры и не зависит от времени и концентрации,
b, d, f - частные порядки по исходным веществам.
Порядок реакции n определяется как сумма частных порядков. В кинетике реакции классифицируют по их порядку: n = 1 - реакция первого порядка, n = 2 - реакция второго порядка и т.д. Реакции с n > 3 практически не встречаются. Очевидно, что размерность константы скорости определяется порядком реакции и составляет [ с1-n, t -1 ]
Молекулярностью реакции называют число частиц, участвующих в элементарной реакции. В отличие от порядка реакции, молекулярность всегда целое число. Различают моно-, би - и тримолекулярные реакции. Порядок и молекулярность реакции совпадают, если процесс является одностадийным.
С точки зрения формальной кинетики необратимыми являются такие реакции, для которых через некоторое время с начала их протекания исходные вещества не удается обнаружить аналитическими методами.
Кинетика простых реакций. Рассмотрим необратимые гомогенные простые реакции нулевого, первого и второго порядков.
Реакции нулевого порядка.
В соответствии с основным постулатом химической кинетики дифференциальное кинетическое уравнение для скорости такой реакции будет иметь вид
-  (4)
(4)
где k0 - константа скорости реакции нулевого порядка,
а - концентрация исходного вещества в начальный момент времени (t = 0),
(a – x) -концентрация исходного вещества в момент времени t (текущая концентрация).
Отсюда, после решения дифференциального уравнения (4), получим интегральное кинетическое уравнение для константы скорости
 (5)
(5)
Как следует из уравнения (5), для реакций нулевого порядка наблюдается линейное уменьшение концентрации исходного вещества с течением времени, что позволяет найти константу скорости также и графически по тангенсу угла наклона прямой в координатах (а - х) - t.
Время полупревращения t 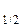 (время, за которое в реакцию вступает половина исходного вещества) определяется выражением
(время, за которое в реакцию вступает половина исходного вещества) определяется выражением
t  =
=  (6)
(6)
Реакции первого порядка
Рассмотрим реакцию типа А ® В. Скорость реакции, выраженная через изменение концентрации вещества А, составит
- 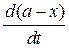 =
= 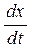 = k1 (a - x) (7)
= k1 (a - x) (7)
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 816; Нарушение авторских прав?; Мы поможем в написании вашей работы!