
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поскольку активности хинона и гидрохинона практически одинаковы, уравнение для потенциала принимает вид
|
|
|
|
Потенциал хингидронного электрода равен
В соответствии с потенциалопределяющей реакцией
C6H4O2 + 2H++ 2е = C6H4(OH)2

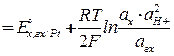 =
=  (12)
(12)
где aх и aг х – активности хинона и гидрохинона соответственно.
 . (13)
. (13)
Таким образом, электрод C6H4O2 ,C6H4(OH)2,H+ ½ Pt может быть использован для определения рН растворов. Значение pH рассчитывается по уравнению
pH =  , (14)
, (14)
где  - потенциал электрода сравнения; E – ЭДС цепи, состоящей из хингидронного электрода и электрода сравнения.
- потенциал электрода сравнения; E – ЭДС цепи, состоящей из хингидронного электрода и электрода сравнения.
Хингидронный электрод может быть использован для измерения pH кислых и слабощелочных растворов (до pH» 8), не содержащих окислителей и восстановителей.
Стеклянный электрод, являющийся наиболее распространенным индикаторным электродом, относится к так называемым ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов; мембранные электроды могут быть обратимы как по катиону, так и по аниону.
При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н+) выражается уравнением
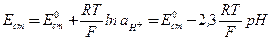 (15)
(15)
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 451; Нарушение авторских прав?; Мы поможем в написании вашей работы!