
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Для амальгамного электрода соответственно запишем
|
|
|
|
Электродный потенциал (с учетом того, что активность вещества в виде конденсированной фазы постоянного состава при данной температуре постоянна и равна единице) составит
Уравнение потенциалопределяющей реакции на электродах, обратимых относительно катионов, имеет вид
В общем случае
ЕOx/Red = Е0Ox/Red + 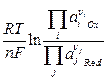 =
= 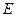 0Ox/Red +
0Ox/Red + 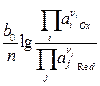 , (4)
, (4)
где Е0Ox/Red – стандартный электродный потенциал,
n – число электронов в элементарной электродной реакции,
b0=2,3 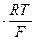 (при 298 K b0 = 0,059).
(при 298 K b0 = 0,059).
К электродам первого рода относятся металлические электроды, обратимые относительно катионов (в том числе и амальгамные) и металлоидные, обратимые относительно анионов: Mn+│M (например Ag+ │ Ag) и An- │ A (например Se2-│Se).
Mn++ nе = M.
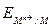 =
= 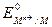 +
+ 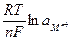 . (5)
. (5)
Mn++ nе = M(Hg)
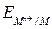 =
= 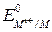 +
+ 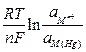 . (6)
. (6)
где aM(Hg ) – активность металла в амальгаме.
К электродам первого рода относятся также газовые электроды (иногда их выделяют в отдельную группу). Они могут быть обратимыми как по отношению к катиону, так и по отношению к аниону. Металл в газовых электродах создает электропроводящий контакт, он должен быть инертен по отношению к веществам, входящим в состав электрода, и способен катализировать только один потенциалопределяющий процесс. Наилучшим образом этим требованиям, отвечает платина, электролитически покрытая платиновой чернью для обеспечения большей поверхности электрода. Примером газовых электродом являются водородный электрод H+ │ H2,Pt, на котором протекает реакция 2H+ + 2е = H2.
При расчете потенциалов газовых электродов активность газов (при небольших давлениях) принимается равной их относительным парциальным давлениям. Стандартный потенциал водородного электрода при всех температурах условно принят равным нулю:
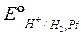
 = 0. (7)
= 0. (7)
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 437; Нарушение авторских прав?; Мы поможем в написании вашей работы!