
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Для растворов слабого электролита степень диссоциации a может быть найдена как
|
|
|
|
Сильные электролиты в растворах любых концентраций полностью диссоциируют на ионы и, следовательно, закономерности, полученные для слабых электролитов, не могут применяться к ним без соответствующих поправок.
Причина диссоциации - взаимодействие растворенного вещества с молекулами растворителя.
Молекулы электролита подвергаются в растворах диссоциации на катионы и анионы. Взаимодействие между ионами отсутствует.
2). Диссоциация может быть полной или частичной, она характеризуется степенью диссоциации α, которая равна отношению числа молекул, распавшихся на ионы, к общему числу молекул
3). По способности к диссоциации электролиты разделяются на сильные (α ≈ 1) и слабые (0 < α < 1).
Процесс диссоциации слабых электролитов обратим и может быть описан константой равновесия, называемой константой диссоциации КД. Для слабого бинарного электролита типа КА справедлив закон разбавления Оствальда
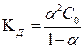 (28)
(28)
Количественные расчеты для растворов сильных электролитов осуществляют с использованием понятий «активность электролита» (а) и «активность ионов» (а+, а-)
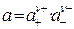 (29)
(29)
Очевидно, что для бинарного электролита, диссоциирующего по схеме КА «К+ + А -, соблюдается равенство  . Следовательно в этом случае
. Следовательно в этом случае  .
.
Экспериментальных методов определения активности отдельных ионов (а + и а –) не существует. Поэтому введено понятие средней ионной активности (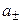 )
)
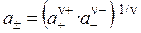 , (30)
, (30)
и среднего ионного коэффициента активности (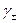 )
)
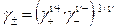 , (31)
, (31)
где 
Теория сильных электролитов позволяет рассчитать средние коэффициенты активности ионов. В области разбавленных растворов справедлив предельный закон Дебая-Гюккеля
 , (32)
, (32)
где A – константа, зависящая от диэлектрической проницаемости растворителя и температуры,
zi – заряд i -ого иона,
I - ионная сила раствора (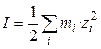 ).
).
Для водных растворов бинарных электролитов при 25°С справедливо соотношение
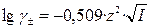 . (33)
. (33)
Электропроводность растворов электролитов.
Растворы электролитов обладают ионной проводимостью (являются проводниками второго рода). В качестве количественной меры способности раствора проводить электрический ток используют удельную электропроводность (æ,Ом-1·см-1). Удельная электропроводность характеризует электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь 1 см2 и расположенными на расстоянии 1 см друг от друга.
Удельная электропроводность раствора связана с его сопротивлением R соотношением
æ  , (34)
, (34)
где l - расстояние между электродами,
S - площадь поперечного сечения электродов.
 |
Удельная электропроводность возрастает с увеличением температуры, что вызвано увеличением скорости движения ионов главным образом из-за понижения вязкости раствора. Обычно при повышении температуры на 1 градус электропроводность увеличивается на 1,5 – 2%.
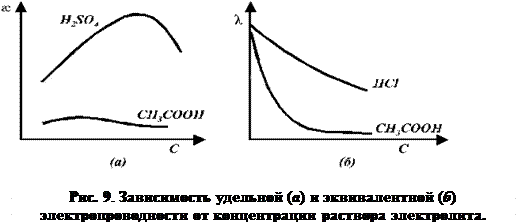
С ростом концентрации электролита æ сначала возрастает в связи с увеличением числа ионов в растворе, однако затем начинает сказываться ион-ионное взаимодействие, приводящее к замедлению движения ионов, а также к их ассоциации. Поэтому почти всегда зависимость удельной электропроводности от концентрации электролита проходит через максимум (см. рис. 9).
Удельную электропроводность легко измерить непосредственно и затем пересчитать в эквивалентную электропроводность λ, позволяющую выделить эффекты ион – ионного взаимодействия. Она представляет собой электропроводность объёма раствора содержащего 1 моль-экв растворенного вещества и заключённого между двумя параллельными электродами соответствующей площади, находящихся на расстоянии в 1 см друг от друга:
Эквивалентная электропроводность (l, Ом-1×(моль-экв)-1×см2) связана с удельной электропроводностью соотношением
 , (35)
, (35)
где C – нормальность раствора электролита (или  , если концентрация выражена в моль –экв∙см-3).
, если концентрация выражена в моль –экв∙см-3).
Эквивалентная электропроводность растворов электролитов с разбавлением возрастает и в области предельных разбавлений достигает значения λ∞ – э лектропроводности при бесконечном разбавлении или предельной эквивалентной электропроводности, соответствующей электропроводности бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами.
В реальном растворе эквивалентная электропроводность электролита зависит от подвижности ионов и подчиняется закону Кольрауша:
– для раствора сильного электролита (a = 1)
l = l+ + l-, (36)
– для раствора слабого электролита
l =a (l+ + l-), (37)
– в бесконечно разбавленном растворе
l¥ = l ¥ + + l ¥ -, (38)
где l+ и l- подвижность катиона и аниона соответственно (подвижность ионов связана с абсолютными скоростями их движения u+ и u- соотношениями l+ = u+×F и l- = u-×F).
Значения l ¥ + и l ¥ - (предельные подвижности ионов) табулированы в справочниках.
 (39)
(39)
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 800; Нарушение авторских прав?; Мы поможем в написании вашей работы!