
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
С учетом закона разбавления Оствальда константа диссоциации для бинарного слабого электролита
|
|
|
|
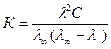 (40)
(40)
 |
Для сильного электролита отношение 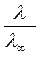 учитывает влияние электростатического взаимодействия ионов на скорость
учитывает влияние электростатического взаимодействия ионов на скорость 
их движения и называется коэффициентом электропроводности.
Измерение электропроводности растворов в процессе титрования лежит в основе кондуктометрического метода исследования, позволяющего установить эквивалентную точку титрования. Метод не требует применения индикаторов и особенно удобен в тех случаях, когда необходимо проанализировать мутные, окрашенные или содержащие осадки растворы. Точку эквивалентности находят по графику “электропроводность – объём титрующего раствора” как точку пересечения двух прямых или точку перегиба. За ходом реакции следят по изменению удельной электропроводности или сопротивления раствора, которое связано с заменой в растворе одних ионов другими, с иной подвижностью. Максимальной подвижностью обладают ионы Н+ (Н3О+) и ОН– . На рис. 10 представлены типичные кривые кондуктометрического титрования.
1.2.3. ЭЛЕКТРОХИМИЯ
Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах, состоящих из проводника первого рода, обладающего электронной проводимостью (металлы) и находящегося в контакте с проводником второго рода, обладающим ионной проводимостью (электролиты). На границе раздела двух фаз происходит перенос электрического заряда, т.е. протекает электрохимическая реакция. Такая система называется электродом.
Если, например, в электродном процессе участвует только одно вещество в окисленной (Ox) и восстановленной (Red) формах, то электродную реакцию можно записать как Ox + nе 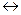 Red.
Red.
Состояние заряженной частицы в фазе определяется величиной электрохимического потенциала
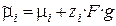 , (1)
, (1)
где zi – заряд иона,
g – внутренний потенциал, отвечающий работе переноса единичного отрицательного заряда из бесконечности в вакууме вглубь фазы.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 603; Нарушение авторских прав?; Мы поможем в написании вашей работы!