
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие электрохимической системы характеризуется равенством электрохимических потенциалов заряженных частиц в различных фазах
|
|
|
|
При переходе заряженных частиц (ионов, электронов) через границу раздела, металл и раствор приобретают электрический заряд, и на границе их раздела создается двойной электрический слой, которому соответствует некоторый скачок потенциала j
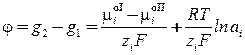 , (2)
, (2)
или 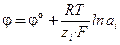 . (3)
. (3)
Поскольку разность электрических потенциалов экспериментально можно измерить только между двумя точками одной и той же фазы, электродный потенциал j нельзя измерить абсолютно.
Для определения относительного значения электродного потенциала измеряют электродвижущую силу (Е) электрохимической цепи, построенной из стандартного водородного электрода и данного электрода. ЭДС такой цепи принимается равной потенциалу данного электрода (ЕOx/Red) .
Классификация электродов.
При схематической записи электрохимических систем, а также уравнений протекающих в них реакций, принято соблюдать следующие основные правила:
– слева от вертикальной черты (граница раздела фаз, на которой возникает скачок потенциала) указывают вещества (ионы), находящиеся в растворе, а справа – вещества, образующие другую фазу, или электродный материал, например
Cu2+│Cu; H+ │ H2, Pt; Co3+, Co2+│Pt.
– уравнение электродной реакции записывается так, чтобы слева располагались вещества в окисленной форме и электроны, а справа вещества в восстановленной форме
Cu2+ + 2е = Cu; Н++ е = 1/2 Н2; Co3+ + е = Co2+.
Электрохимической характеристикой электрода является электродный потенциал (ЕOx/Red), величина которого вычисляется по уравнению Нернста.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 497; Нарушение авторских прав?; Мы поможем в написании вашей работы!