
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионное произведение воды
|
|
|
|
Наиболее важным из всех растворителей является вода. Вода, являясь слабым электролитом, в незначительной степени подвергается ионизации с образованием ионов гидроксония и гидроксила:
H2O + H2O D H3O+ + OH-.
По закону действия масс константу равновесия процесса ионизации воды можно записать в виде:

Измерение электропроводности чистой воды показали, что концентрации [OH-]=[H3O+]=1.10-7 моль/л, а концентрация чистой воды равна [H2O]=1000/18=55,56 моль/л. Тогда константа диссоциации воды может быть легко рассчитана по закону действия масс:
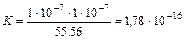
Диссоциация воды очень незначительна, поэтому концентрацию ее можно считать практически неизменной и ввести в константу, тогда:
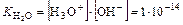
т.е. произведение концентраций ионов воды есть величина постоянная при данной температуре. Ее называют ионным произведением воды и обозначают 
 или Kw.
или Kw.
Соотношение концентраций ионов гидроксония и гидроксила определяет кислотность среды.
Если
[H3O+]>[OH-] – среда кислая,
[H3O+]<[OH-] – среда щелочная,
[H3O+]=[OH-] – среда нейтральная.
Так как концентрации ионов гидроксония и гидроксила в нейтральном растворе равны 1.10-7 моль/л – величине очень маленькой, то кислотность раствора целесообразно характеризовать не концентрацией, а водородным или гидроксильным показателем (отрицательным логарифмом концентрации):
pН=-lg[H3O+] или pOH=-lg[OH-].
Характер среды водных растворов можно определить следующими значениями рН:
pН<7 – среда кислая,
pH=7 – среда нейтральная,
pH>7 – среда щелочная.
Если прологарифмировать выражение для ионного произведения воды и умножить левую и правую часть на -1, то можно получить связь между рН и рОН раствора:
-lg10-14=-lg[H3O+] – lg[OH-]
14=pH+pOH
Так как в реальных растворах существуют межионные взаимодействия, кислотность среды нужно характеризовать не концентрацией ионов водорода (гидроксония), а их активностью, поэтому расчет рН проводят по формуле:
рН = -lg a H+ = -lg(f H+× c H+).
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1297; Нарушение авторских прав?; Мы поможем в написании вашей работы!