
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет рН в растворах сильных кислот и оснований
|
|
|
|
Сильные кислоты и основания в водных растворах полностью диссоциируют на ионы. Сильными в водном растворе являются все галогеноводородные кислоты, за исключением HF, хлорная, азотная, серная и некоторые другие минеральные кислоты. В водных растворах сильных кислот протолитическое равновесие полностью сдвинуто вправо
HA→ H+ + A-
Вследствие полной диссоциации сильных кислот концентрация ионов водорода равна концентрации кислоты НА. Водородный показатель для сильных кислот типа НА рассчитывают по формуле рН = -lg с H+ = -lg с HA, когда раствор кислоты не слишком разбавлен (с НА ³ 10-6 М), и с учетом ионной силы раствора (с НА > 10-3 М) - по формуле рН = -lg a H+ = -lg(f H+× c HA).
Пример1. Рассчитайте рН 0,001М раствора азотной кислоты.
Решение:
HNO3 → H+ + NO3 –
[H+]= с HА = 0,001М
рН=3
pН<7 – среда кислая,
Пример 2. Рассчитайте рН в 0,1 М водном растворе HCl.
Решение:
HCl → H+ + Cl-
Так как HCl является сильным электролитом, концентрация которого в растворе >10 -3, при расчете рН раствора необходимо учитывать ионную силу раствора:
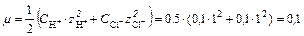
Для данной ионной силы по справочнику найдем значение коэффициента активности для ионов Н+ или рассчитаем по формуле
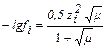
f H+=0,83,
тогда 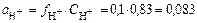 , а
, а
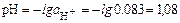
pН<7 – среда кислая
Сильными основаниями в водных растворах являются гидроксиды щелочных и щелочно-земельных металлов (например, NaOH, KOH, Ba(OH)2). Поскольку они диссоциированы также нацело, в растворах сильных оснований концентрация ионов гидроксила равна концентрации гидроксида типа NaOH или удвоенной концентрации гидроксида типа Ba(OH)2 Аналогично рассчитывают гидроксильный показатель для сильных оснований. В случае 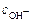 ≥10-6 М применяют формулу рОН = -lg[OH-], а при
≥10-6 М применяют формулу рОН = -lg[OH-], а при 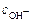 > 10-3 М - формулу рОН =
> 10-3 М - формулу рОН = 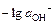 = -lg(f OH-×
= -lg(f OH-× 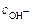 ).
).
Пример 3. Рассчитать рН основания в водном растворе 0,05 М NaOH
Решение:NaOH → Na+ + OH-
Так как NaOH является сильным электролитом и 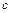 > 10-3 М, то при расчете рН необходимо учитывать ионную силу раствора:
> 10-3 М, то при расчете рН необходимо учитывать ионную силу раствора: 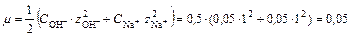
Коэффициент активности иона OH- при данной ионной силе раствора равен f OH-=0,81, тогда:
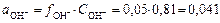 , а
, а
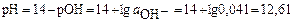
рН>7 т.е.среда щелочная.
Расчет рН растворов слабых кислот и оснований.
В растворах слабых электролитов концентрация ионов мала, межионные взаимодействия проявляются в незначительной степени, коэффициенты активности ионов стремятся к единицы, поэтому расчеты можно проводить без учета влияния ионной силы. В растворе слабой кислоты устанавливается равновесие
НА DН+ +А-.
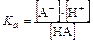
Так как кислота одноосновная, то при ее диссоциации получаются равные количества ионов А- и H+ т.е. [А-] = [H+]. Если кислота диссоциирована мало(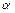 < 5%), можно считать, что С НА@[НА]. С учетом этих допущений расчет равновесных концентраций, рН, степени диссоциации для раствора слабой кислоты можно проводить, опираясь на формулы:
< 5%), можно считать, что С НА@[НА]. С учетом этих допущений расчет равновесных концентраций, рН, степени диссоциации для раствора слабой кислоты можно проводить, опираясь на формулы:
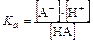
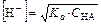
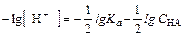
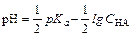

В растворах слабых оснований устанавливается равновесие
ВОН DВ+ +ОН-.
Рассуждая аналогично, можно вывести формулы для расчета равновесных концентраций, рН, рОН и степени диссоциации раствора слабого основания
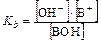
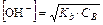
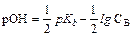
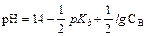
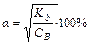
Для проведения расчетов примем следующий порядок записи. В первой строке под уравнением реакции пишем исходную концентрацию(C0), во второй строке равновесные концентрации частиц [ ].
Пример 1. Рассчитайте равновесные концентрации, рН и степень диссоциации водного раствора 0,1 М CH3COOH.
Решение: Так как кислота одноосновная, то при ее диссоциации получаются равные количества ионов CH3COO- и H+, поэтому, обозначив за x концентрацию кислоты подвергающейся диссоциациив момент равновесия, получим равновесные концентрации H+ -иона и аниона также равные x. Остаточная концентрация кислоты будет (0,1- x).
CH3COOH D CH3COO- + H+
C0 0,1
[ ] 0,1– x x x
Согласно закону действия масс:
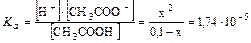
Если отношение 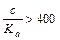 , тогда x в знаменателе можно пренебречь:
, тогда x в знаменателе можно пренебречь:
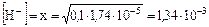
степень диссоциации 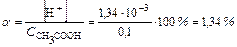 ,
,
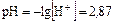
рН<7 т.е. среда кислая.
Пример 2. Рассчитайте равновесные концентрации, рН и степень диссоциации водного раствора 0,1 М NH4OH.
Решение:
NH4OH D NH4+ + OH-
C0 0,1
[ ] 0,1 – x x x
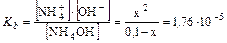
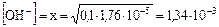
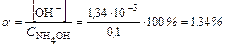

рН>7 т.е. среда щелочная.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 7290; Нарушение авторских прав?; Мы поможем в написании вашей работы!