
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей
|
|
|
|
Задачи для самостоятельного решения.
1. Рассчитайте рН:
a) 0,001 М раствора уксусной кислоты;
b) 0,01 М раствора муравьиной кислоты;
c) 0,0001М раствора соляной кислоты.
Ответ:
рН=3,9
рН=2,6
рН=4
2. Рассчитайте рН:
a) 0,0001 М раствора гидроксида натрия;
b) 0,0002 М раствора гидроксида кальция;
c) 0,05М гидроксида калия
Ответ:
рН10
рН10,6
рН12,6
3. Рассчитайте рН, равновесные концентрации ионов и степень диссоциации 0,1 М раствора муравьиной кислоты.
Ответ: рН=2,37;α=4,24%; [COOН-]=[Н+]=4,24∙10 -3моль/л
4. Равновесная концентрация ионов водорода в растворе синильной кислоты НСN равна 5,34∙10 -3М. Определите рН и рОН раствора данной кислоты.
Ответ: рН5,27;рОН 8,73.
5. Рассчитайте рН, рОН|, равновесные концентрации ионов и степень диссоциации 0,01 М раствора гидроксида аммония.
Ответ: рН 10,63;рОН 3,37 α=4,24%;[NН+]=[ОН-]=4,24∙10 -4моль/л.
6. Рассчитайте рН раствора, содержащего 0,01 моль/л НСl и 0,01моль/л СaCl2
Ответ: рН 2,07
7. Сравнить степень диссоциации муравьиной кислоты в растворах, содержащих:
а) 0,1 моль/л муравьиной кислоты;
b) 0,1 моль/л муравьиной кислоты и 0,1 моль/л хлорида калия;
c) 0,1 моль/л муравьиной кислоты и 0,1 моль/л азотной кислоты;
Ответ:a)4,24%; b)5,6%; c) 0,3%.
Гидролизом называется химическая реакция взаимодействия заряженных частиц растворенной соли с водой, где вода проявляет амфипротные свойства, в результате чего образуются слабодиссоциируемые соединения и смещается равновесие диссоциации воды. В результате гидролиза солей, как правило изменяется рН раствора по причине накопления ионов Н3О+ или ОН-. В результате гидролиза солей среда может оказаться кислой, щелочной или нейтральной. Например:
NH4+ + 2H2O ⇄ NH4OH + H3O+ pH<7
CNS- + H2O ⇄ HCNS + OH- pH>7
2NH4+ + S2- + H2O ⇄ NH4OH + NH4+ + HS- pH≈9
Гидролизу подвергаются три типа солей:
1. Cоли, образованные слабой кислотой и сильным основанием (гидролиз по аниону).
2. Cоли, образованные слабым основанием и сильной кислотой (гидролиз по катиону).
3. Соли, образованные слабой кислотой и слабым основанием (гидролиз по катиону и аниону).
Количественно гидролиз характеризуется константой гидролиза (Kг), степенью гидролиза(h), реже рН. Константа гидролиза солей равна отношению ионного произведения воды к константе диссоциации слабого электролита, входящего в состав данной соли (см. табл.2.3). Степень гидролиза показывает, какая часть от общего количества растворенной в воде соли подверглась гидролизу
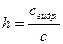
Степень гидролиза зависит от следующих факторов: силы кислоты или основания, образующихся при гидролизе соли (чем меньше К а или Kb, тем больше h); температуры раствора (нагревание усиливает гидролиз, так как способствует увеличению степени диссоциации воды); концентрации раствора (в разбавленных растворах гидролиз также протекает глубже). Регулируя указанные факторы, можно сместить равновесие реакции гидролиза в нужном направлении. Формулы для расчёта количественных характеристик гидролиза в различных типах солей приведены в таблице 2.3
Таблица 2.3 Формулы для расчёта количественных
характеристик гидролиза в различных типах солей.
| Показатели | Соль, образованная | ||
| слабой кислотой и сильным основанием | слабым основанием и сильной кислотой | слабой кислотой и слабым основанием | |
| Кг | 
| 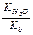
| 
|
| h | 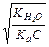
| 
| 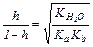
|
| [H +] | 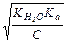
| 
| 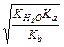
|
| pH | 
| 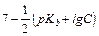
| 
|
Гидролиз по аниону.
Процесс гидролиза соли, образованной сильным основанием и слабой кислотой можно представить в общем виде:
H2O ⇄ H+ + OH- Kw
A- + H+ ⇄ HA 1/Ka
____________________________
A- + H2O ⇄ HA + OH- Kг=Kw/Ka
C0 c
[ ] c-x x x
Константа гидролиза равна произведению констант каждой стадии Kг=Kw/Ka,. Чем меньше Ka, т.е. чем слабее кислота, тем больше константа гидролиза, тем гидролиз протекает полнее. Константа гидролиза возрастает с повышением температуры, т.к. Kw увеличивается.
Поскольку гидролиз- обратимый процесс, можно записать:
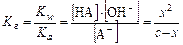
Для случая, когда с/Кг >>400, х в знаменателе можно пренебречь.

Возьмем отрицательный логарифм данного выражения:


Так как рОН+рН= 14, то рН=14-рОН
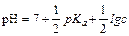
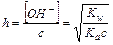
Гидролиз по катиону.
Процесс гидролиза соли, образованной слабым основанием и сильной кислотой можно представить в общем виде:
H2O ⇄ H+ + OH- Kw
M+ + OH- ⇄ MOH 1/Kb
____________________________
M+ + H2O ⇄ MOH + H + Kг=Kw/Kb
C0 c
[ ] c-x x x

Для случая, когда с/Кг >>400, х в знаменателе можно пренебречь.


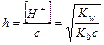
Гидролиз по катиону и аниону.
Гидролиз солей, образованных нейтрализацией слабого основания слабой кислотой, можно представить в общем виде:
H2O ⇄ H+ + OH- Kw
M+ + OH- ⇄ MOH 1/Kb
A- + H+ ⇄ HA 1/Ka
____________________________
M+ + A- + H2O ⇄ MOH + HA Kг=Kw/(Ka.Kb)
c c
[ ] c- x c- x x x
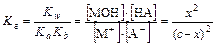

Для расчета [H+] выразим [HA] через константу кислотной диссоциации:
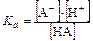

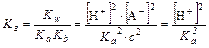
т.к. [A-]≈c,
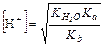

Степень гидролиза h
 .
.
Степень гидролиза можно также рассчитать, используя выражение:
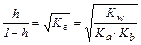 .
.
Приведенные формулы показывают, что для данного типа гидролиза константа гидролиза истепень гидролиза не зависят от концентрации соли в растворе, а рН определяется соотношением сильной кислоты и основания, которые образуют данную соль.
Пример 1. Вычислите рН и степень гидролиза соли NaClO (С=0,1 моль/л) pKa= 7,53.
Решение:
NaClO → Na+ + ClO-
H2O ⇄ H+ + OH - Kw
ClO- + H+ ⇄ HClO 1 /Ka= 7, 53.10-8
______________________________________
ClO- + H2O ⇄ HClO + OH- Kг=Kw/Ka= 3, 33.10-7
C0 0,1
[ ] 0,1-x x x

Так как с/Кг = 0,1/ 3,33.10-7 = 3.109>>400 то


pH=14- pOH=10,27
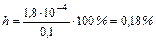
Если соль образована многоосновными кислотами или основаниями, то гидролиз ее будет проходить ступенчато:
1 ступень: H2O ⇄ H+ + OH- Kw
A n- + H+ ⇄ HA(n-1)- 1/ K HA (n-1)
______________________________
A n- + H2O ⇄ HA(n-1)- + OH- Kг`=Kw/ K HA (n-1)
2 ступень:H2O ⇄ H+ + OH- Kw
HA(n-1)- + H+ ⇄ H2A(n-2)-1 /K H 2A (n-2)
______________________________
HA(n-1)- + H2O ⇄ HA(n-2)- + OH- Kг``=Kw/ K H 2 A (n-2)
Так как K H2A (n-2) >> K HA (n-1), следовательно Kг`>>Kг``.
Поэтому при расчете рН раствора cоли образованной слабой многоосновной кислотой или слабым многокислотным основанием второй ступенью гидролиза пренебрегают.
Пример2. Вычислите равновесные концентрации и рН раствора при гидролизе соли Na2CO3 (C=0,1 моль/л), Ka1= 4,5.10-7, Ka2 =4,8.10-11.
Решение:
Так как Ka1>>Ka2, то при гидролизе соли учитываем только первую ступень:
Na2CO3 → 2Na+ + CO32-
H2O ⇄ H+ + OH- Kw
CO32- + H+ ⇄ HCO3- 1/Ka2
___________________________
CO32- + H2O ⇄ HCO3- + OH - Kг= Kw/Ka2
C0 0,1
[ ] 0,1- x x x
Kг= Kw/Ka2= 1. 10-14/4,8. 10-11=2,08. 10-4
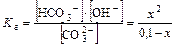 =2,08. 10-4
=2,08. 10-4
Так как с/Кг = 0,1/2,08. 10-4 = 4,81.102>>400, то
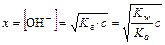

pOH=-lg  = 2,34
= 2,34
pH=14-pOH= 11,66
Вопросы для самоконтроля:
1. Дайте определение реакции гидролиза с позиций теории Бренстеда –Лоури.
2. Приведите примеры солей, которые подвергаются гидролизу. Определите тип гидролиза и кислотность среды в растворе соли.
3. Составьте уравнение реакции гидролиза по катиону для солей: NН4Сl, Cu(NO3)2
4. Составьте уравнение реакции гидролиза по аниону для солей: КСN, Na3РO4
5. Составьте уравнение реакции гидролиза по катиону и аниону для солей: СН3 СOОNН4 , Cu2 S
6. Выведете формулы для расчёта Кг, h, рНв растворах солей, подвергающихся гидролизу.
7. Поясните, исходя из соответствующих формул, как меняется степень гидролиза с разбавлением и нагреванием раствора соли?
8. От каких факторов зависит константа гидролиза?
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1203; Нарушение авторских прав?; Мы поможем в написании вашей работы!