
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет рН слабых кислот и оснований в присутствии сильного электролита, содержащего и не содержащего одноименные ионы
При расчете равновесных концентраций и рН в растворах слабых кислот и оснований в присутствии сильного электролита, не содержащего одноименные ионы со слабым электролитом, необходимо учитывать влияние ионной силы раствора, т.е. при расчете использовать активную концентрацию ионов. Ионная сила в таких системах определяется только ионами сильного электролита. За счет влияния ионной силы раствора активная концентрация ионов слабого электролита снижается, вследствие чего равновесие в реакции диссоциации смещается вправо. Сильные электролиты повышают степень диссоциации слабого электролита, если сильный электролит не содержит одноименных ионов.
Пример 1. Рассчитайте равновесные концентрации, рН и степень диссоциации в 0,1 М растворе CH3COOH в присутствии 0,1 М KCl.
Решение: Ионная сила раствора определяется ионами сильного электролита:
KCl → K+ + Cl-
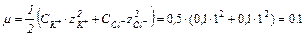
Для данной ионной силы по справочнику найдем значение коэффициентов активности для ионов Н+ и CH3COO- или рассчитаем по формуле:
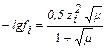
f H+ =0,83, f CH3COO- =0,775
Так как:
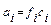
равновесные концентрации уксусной кислоты в растворе хлорида калия можно записать как
CH3COOH D CH3COO- + H+
C0 0,1
[ ] 0,1 – x 0,775x 0,83x
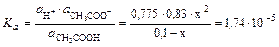
Если отношение 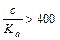 , тогда x в знаменателе можно пренебречь:
, тогда x в знаменателе можно пренебречь:
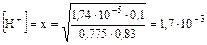
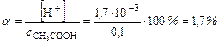 ,
,
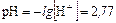
В присутствии KCl степень диссоциации CH3COOH увеличилась в 1,2 раза (см. пример 1 стр.21).
При расчете равновесных концентраций и рН в растворах слабых кислот и оснований в присутствии сильного электролита, содержащего одноименные ионы, необходимо учитывать как влияние ионной силы раствора, так и влияние одноименных ионов. За счет межионных взаимодействий понижается активная концентрация ионов слабого электролита, что приводит к смещению равновесия вправо, а одноименные ионы сильного электролита смещают равновесие влево. Ионная сила определяется ионами сильного электролита. Как правило, влияние одноименного иона является определяющим и степень диссоциации слабого электролита понижается.
Пример 2. Рассчитайте рН и степень диссоциации в 0,1 М растворе CH3COOH в присутствии 0,1 М HCl.
Решение: Ионная сила раствора определяется ионами сильного электролита:
HCl → H+ + Cl-
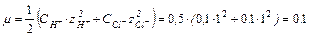
Для данной ионной силы по справочнику найдем значения коэффициентов активности для ионов Н+ и CH3COO- или рассчитаем по формуле:
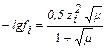
f H+=0,83, f CH3COO-=0,775
В данном случае необходимо учитывать вклад 0,1 М HCl при расчете равновесных концентраций уксусной кислоты. Активность ионов водорода равна 0,83(0,1+ x) и процесс диссоциации можно записать как
CH3COOH D CH3COO- + H+
C0 0,1
[ ] 0,1 – x 0,775 x 0,83∙(0,1+ x)
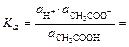
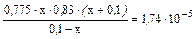
Так как отношение 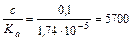 >400, то x в знаменателе и в числителе, стоящем в скобках можно пренебречь (x <<0,1):
>400, то x в знаменателе и в числителе, стоящем в скобках можно пренебречь (x <<0,1):
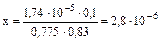
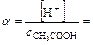
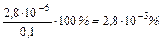 ,
,
В присутствии HCl диссоциация CH3COOH уменьшилась в 479 раз.
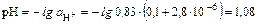
В данном случае рН раствора определяется ионами водорода, образовавшимися в результате диссоциации сильной кислоты. Влияние ионов H+, образовавшихся в результате диссоциации слабой кислоты незначительно и их вкладом можно пренебречь.
Вопросы для самоконтроля:
1. Дайте определение кислоты и основания по теории Бренстеда-Лоури?
2. Приведите примеры положительно и отрицательно заряженных кислот и оснований по теории Бренстеда-Лоури.
3. Что такое амфолит? Приведите примеры.
4. В чем преимущества теории Бренстеда-Лоури по сравнению с теорией Аррениуса?
5. Что такое сопряженная кислотно-основная пара? Приведите примеры.
6. Какая реакция называется реакцией автопротолиза?
7. Как классифицируют растворители в зависимости от их протолитических свойств?
8. Как влияет растворитель на силу кислот и оснований?
9. Какие факторы влияют на величину ионного произведения воды?
10. Что такое рН и рОН? Их математическая связь.
11. Выведите формулы для расчёта рН в растворах сильных кислот и оснований
12. Сделайте вывод формул для расчёта рН и степени диссоциации в растворах слабых кислот.
13. Сделайте вывод формул для расчёта рН и степени диссоциации в растворах слабых оснований.
14. Как влияет на степень диссоциации слабого электролита присутствие сильного электролита, содержащего и не содержащего одноименный ион со слабым электролитом?
|
|
Дата добавления: 2014-11-16; Просмотров: 2167; Нарушение авторских прав?; Мы поможем в написании вашей работы!