
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные химические понятия
|
|
|
|
Теоретическая часть
Работа 1. Определение молярных масс газообразных веществ
Задания для подготовки к лабораторной работе
1. Повторите важнейшие законы газового состояния (Бойля – Мариотта, Гей-Люссака, Шарля, Авогадро, объединенный газовый закон), уравнение Клапейрона – Менделеева; понятия об относительной молекулярной (относительной атомной) и молярной массах, моле, абсолютной и относительной плотности веществ; методы определения молярных масс веществ в газообразном состоянии.
2. Ознакомьтесь с устройством аппарата Киппа и методикой определения молярной массы оксида углерода (IV).
Химический элемент – совокупность атомов естественного изотопического состава этого элемента с одинаковым зарядом ядра.
Изотопы – разновидности атомов химического элемента с одинаковым порядковым номером и отличающиеся друг от друга количеством нейтронов и массовыми числами (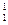 Н;
Н; 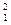 Н;
Н; 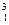 Н;
Н; 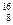 О;
О; 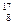 О;
О; 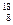 О).
О).
Атом – наименьшая частица химического элемента, являющаяся носителем его свойств и неделимая при химических реакциях.
Молекула – наименьшая частица простого или сложного вещества, определяющая его свойства, способная к самостоятельному существованию; состоит из атомов одного (простое вещество) или различных (сложное вещество) химических элементов (С, Si, P4, S8, O2, O3, Г2, N2, Fe, Cu – простые вещества; Н2О, СО2, СаСО3, Са3(РО4)2 – сложные вещества).
Ион – это заряженная частица – атом или группа химически связанных атомов, несущая на себе, при недостатке электронов, положительный заряд и называющаяся катионом, а при избытке электронов, отрицательный заряд и называющаяся анионом (Сl−, Са2+, РО 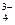 ).
).
Вещество – это форма материи, состоящая из атомов, молекул или ионов.
Структурные единицы – любой вид реальных частиц (атомов, молекул, ионов, электронов и т. п.) и условно существующие доли таких частиц (1/3 Н3РО4; 1/5 КМnО4; 1/3 Аl; 1/2 СаСО3; 1/2 Ва2+ и т. п.).
Число Авогадро – число атомов изотопа углерода  С в 12,0000 г этого вещества. NА = 6,0221367 · 1023 ≈ 6,022 · 1023 атомов.
С в 12,0000 г этого вещества. NА = 6,0221367 · 1023 ≈ 6,022 · 1023 атомов.
Постоянная Авогадро – константа, численно равная числу Авогадро и показывающая число соответствующих структурных единиц в 1 моле таких единиц. NА = 6,0221367 · 1023≈6,022 · 1023 моль−1.
NА = 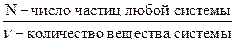
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 358; Нарушение авторских прав?; Мы поможем в написании вашей работы!