
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экспериментальная часть
|
|
|
|
Пример.
а) Относительная плотность СО2 по Н2:
D 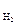 =
=  =
=  , где m
, где m 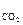 и m
и m 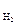 – массы СО2 и Н2 при одинаковых V, Р, Т; М
– массы СО2 и Н2 при одинаковых V, Р, Т; М 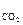 и М
и М 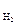 – молярные массы СО2 и Н2, т.е. массы СО2 и Н2 объемом 22,4 л при н.у. М
– молярные массы СО2 и Н2, т.е. массы СО2 и Н2 объемом 22,4 л при н.у. М 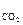 = D
= D 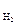 · M
· M 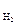 .
.
б) Относительная плотность СО2 по воздуху:
Dвозд.=  =
=  . М
. М 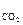 = Dвозд. · Мвозд..
= Dвозд. · Мвозд..
Уравнение Клапейрона – Менделеева:
PV = ν RT = 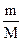 RT; P, V, T – условия, при которых проводится опыт; ν – количество вещества; R – универсальная газовая постоянная, которая рассчитывается по формуле R =
RT; P, V, T – условия, при которых проводится опыт; ν – количество вещества; R – универсальная газовая постоянная, которая рассчитывается по формуле R =  , ν = 1 моль.
, ν = 1 моль.
а) R = 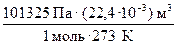 = 8,314
= 8,314 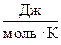 .
.
Па = 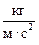 ; Дж =
; Дж =  = Па · м3.
= Па · м3.
б) R = 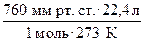 = 62,4
= 62,4 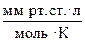 ;
;
R = 62 400  .
.
в) R =  = 8,314
= 8,314 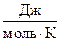 .
.
Из уравнения Клапейрона – Менделеева:
М х =  , где М х – молярная масса определяемого газа; m – его масса; P, V, T – давление, объем, температура, соответствующие условиям опыта. Для углекислого газа М
, где М х – молярная масса определяемого газа; m – его масса; P, V, T – давление, объем, температура, соответствующие условиям опыта. Для углекислого газа М 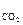 =
=  .
.
Опыт 1. Определение молярной массы оксида углерода (IV)
Целью лабораторной работы является знакомство с методами определения молярной массы газа на примере оксида углерода (IV), приобретение навыков взвешивания и расчетов по газовым законам.
1. Собрать прибор, как показано на рис. 1.
2. Записать уравнение реакции получения СО2.
3. Сухую колбу с воздухом плотно закрыть пробкой и восковым карандашом сделать отметку по глубине вхождения пробки в горло колбы.
 1 – шарообразная воронка;
1 – шарообразная воронка;
2, 3– соединенные между собой резервуары;
4, 5 – тубусы; 6– кран;
7 – перетяжка,
8, 9– промывные склянки;
10 – приемник СО2.
Рис. 1. Установка для получения и очистки диоксида углерода, состоящая из аппарата Киппа, промывных склянок и приемника СО2.
 4. Взвесить колбу с пробкой и воздухом на весах (рис. 2), записать в журнале: m1 (г) – масса колбы с пробкой и воздухом.
4. Взвесить колбу с пробкой и воздухом на весах (рис. 2), записать в журнале: m1 (г) – масса колбы с пробкой и воздухом.
5. Наполнить колбу оксидом углерода (IV) из аппарата Киппа, опустив конец газоотводной трубки до дна колбы. Скорость пропускания газа отрегулировать так, чтобы его пузырьки можно было считать при про-
Рис. 2 Весы лабораторные хождении их через склянки с водой (или ратвором
компактные NaHCO3) и концентрированной серной кислотой.
6. Полноту наполнения колбы углекислым газом проверить с помощью горящей лучины. Держа колбу в вертикальном положении, вставить в нее пробку. Закрыть кран аппарата Киппа.
 7. Взвесить колбу с диоксидом углерода, записать результат взвешивания: m2 (г) – масса колбы с пробкой и СО2.
7. Взвесить колбу с диоксидом углерода, записать результат взвешивания: m2 (г) – масса колбы с пробкой и СО2.
8. Провести контрольный опыт: колбу повторно наполнить углекислым газом из аппарата Киппа, закрыть ее и снова взвесить. Разница между взвешиваниями не должна быть больше 0,02 г, в противном случае опыт повторить.
9. Записать значения температуры и давления во время проведения эксперимента.
10. Для измерения объема (V) колбы и соответственно объема газов, заполняющих ее, наполнить колбу до метки водой комнатной температуры.
11. Измерить объем воды, перелив ее из кол-бы в мерный цилиндр (рис. 3) и результат измерения Рис. 3 Мерные цилиндры
(V, мл) при условиях проведения эксперимента записать в журнал. 12. Привести объем (V) газа к н.у. (V0), используя объединенный газовый закон:
 =
=  ; V0 =
; V0 =  .
.
13. Зная V0, рассчитать массу воздуха в объеме колбы (m3):
m3 = 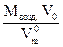 =
= 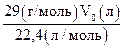 (по закону Авогадро).
(по закону Авогадро).
14. Рассчитать массу пустой колбы (без воздуха): m4 = m1 – m3 (из массы колбы с воздухом вычесть массу воздуха).
15. Рассчитать массу СО2 в объеме колбы (m5):
m5 = m2 – m4 (из массы колбы с СО2 вычесть массу пустой колбы).
16. Рассчитать М 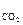 (эксп.) по методу Авогадро:
(эксп.) по методу Авогадро:
М 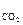 (эксп.) =
(эксп.) =  , где V0 рассчитывается по п.12.
, где V0 рассчитывается по п.12.
17. Рассчитать Dвозд. = 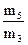 ; М
; М 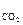 (эксп.) = Мвозд. · Dвозд. (метод расчета М
(эксп.) = Мвозд. · Dвозд. (метод расчета М 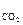 , используя его относительную плотность по воздуху).
, используя его относительную плотность по воздуху).
18. Если колбу заполнить водородом, то его масса в объеме колбы (m6) будет равной:
m6 = 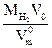 =
= 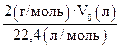 .
.
19. Рассчитать D 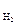 : D
: D 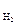 =
= 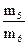 ; М
; М 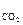 (эксп.) = М
(эксп.) = М 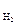 · D
· D 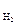 .
.
20. Рассчитать М 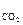 (эксп.) по уравнению Клапейрона – Менделеева:
(эксп.) по уравнению Клапейрона – Менделеева:
М 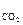 (эксп.) =
(эксп.) = 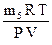 , где Р, V, Т – условия проведения эксперимента.
, где Р, V, Т – условия проведения эксперимента.
21. Рассчитать М 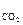 (теор.) = М(С) + М(О) · 2.
(теор.) = М(С) + М(О) · 2.
22. Рассчитать относительную ошибку опыта по формуле
К = 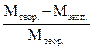 · 100, %. Ошибка не должна превышать 2 %.
· 100, %. Ошибка не должна превышать 2 %.
Следует уметь:
1. Пользоваться аппаратом Киппа.
2. Взвешивать на электронных весах.
3. Заполнять сосуды газами различной плотности.
4. Экспериментально определять массу и объем газа при определенных температуре и давлении.
5. Рассчитывать молярную массу вещества по полученным экспериментальным данным различными способами: а) по методу Авогадро; б) используя относительную плотность одного газа по другому газу; в) по уравнению Клапейрона – Менделеева.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1831; Нарушение авторских прав?; Мы поможем в написании вашей работы!