
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример. 1 моль Са3(РО4)2 весит столько, чему равна его молярная масса
|
|
|
|
Пример.
Пример.
1 моль Са3(РО4)2 весит столько, чему равна его молярная масса. М[Са3(РО4)2] = 3 · М (Са) + 2 · М (Р) + 8 · М (О) = 3 · 40,078 + 2 · 30,974 + 8 · · 15,999 = 310,174 г/моль.
Масса 1 моля Са3(РО4)2 или 6,022 · 1023 молекул Са3(РО4)2 равна 310,174 г.
Атомная единица массы (а.е.м.) (другое название – углеродная единица (у.е.)). Она равна 1/12 части массы атома легкого изотопа углерода с массовым числом 12. Атомная единица массы – величина постоянная, равная 1,6605402 · 10−24 г.
1 а.е.м. = 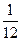 mат. (
mат. ( С) =
С) = 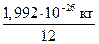 ≈ 0,166 · 10−26 кг.
≈ 0,166 · 10−26 кг.
Единицы измерения а.е.м. – граммы, килограммы и т. д.
Масса атомов и молекул. mат., mмол-лы выражается очень малыми величинами порядка 10−26 кг.
m (Н) = 0,167 · 10−26 кг = 1,0079 · а.е.м.
m ( С) = 1,994 · 10−26 кг = 12,011 · а.е.м.
С) = 1,994 · 10−26 кг = 12,011 · а.е.м.
m (СО2) = 7,305 · 10−26 кг = 12,011 · а.е.м. + 2 · 15,999 · а.е.м.
Единицы измерения масс атомов и молекул: кг, г, а.е.м. и т. д.
mат = 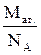 = Аr · а.е.м.; mмол-лы =
= Аr · а.е.м.; mмол-лы = 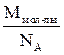 = Мr · а.е.м.
= Мr · а.е.м.
mлюбого числа частиц: m (N) = 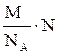 = M · ν.
= M · ν.
mат. ( С) =
С) = 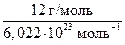 = 1,992 · 10−26 кг;
= 1,992 · 10−26 кг;
mат. ( С) =
С) = 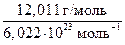 = 1,994 · 10−26 кг.
= 1,994 · 10−26 кг.
Относительная атомная масса (Аr) показывает, во сколько раз средняя масса атома естественного изотопического состава элемента больше 1 а. е. м. Значения Аr приводятся в периодической системе элементов Д. И. Менделеева. Аr можно рассчитать по формуле Аr = 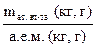 . Аr − величина безразмерная. Подстрочная буква «r» − первая буква английского слова relative или латинского relativus – относительный, сравнительный; масса атома сравнивается с 1 а.е.м.
. Аr − величина безразмерная. Подстрочная буква «r» − первая буква английского слова relative или латинского relativus – относительный, сравнительный; масса атома сравнивается с 1 а.е.м.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1415; Нарушение авторских прав?; Мы поможем в написании вашей работы!