
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 3. Основы термодинамики
|
|
|
|
Химические системы характеризуют такие величины как внутренняя энергия U, энтальпия H, энтропия S и энергия Гиббса G (изобарно-изотермический потенциал). Все они являются функциями состояния, то есть зависят только от состояния системы, но не от способа, которым это состояние достигнуто.
Энтальпия Н – одна из термодинамических функций состояния системы. Изменение энтальпии ∆Н равно тепловому эффекту химической реакции, протекающей в изобарно-изотермических условиях (р = const, Т = const), когда единственным видом работы является расширение газа. Если ∆Н < 0, процесс идет с выделением теплоты в окружающую среду (экзотермическая реакция), если ∆Н > 0, процесс идет с поглощением теплоты (эндотермическая реакция).
Тепловой эффект химического процесса, протекающего в условиях р, Т = const, A = p∆V, не зависит от пути его протекания, а зависит от природы и физического состояния исходных веществ и продуктов реакции (закон Гесса). Cледствие из закона: тепловой эффект химической реакции (DН х.р.) равен сумме стандартных теплот образования (DН °обр.) конечных продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ с учётом стехиометрических коэффициентов (n, m).

Используя первое следствие из закона Гесса, удобно вычислить стандартный тепловой эффект реакции при 298 К, поскольку стандартные теплоты образования различных веществ при Т = 298К можно найти в таблицах термодинамических констант. Стандартные теплоты образования простых веществ равны нулю, если их агрегатные состояния и модификации устойчивы при Т = 298 К и давлении 0,1 МПа.
Энтропия S так же, как и энтальпия Н, является термодинамической функцией состояния системы, поэтому ее изменение ∆S в процессе химической реакции можно подсчитать, используя следствие из закона Гесса
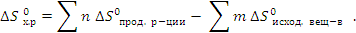
Стандартное изменение энтропии  легко вычислить, используя таблицы термодинамических констант. Единица измерения энтропии – Дж/(моль·К). Величина S (энтропия) является мерой неупорядоченности системы.
легко вычислить, используя таблицы термодинамических констант. Единица измерения энтропии – Дж/(моль·К). Величина S (энтропия) является мерой неупорядоченности системы.
Её значение увеличивается с ростом температуры и уменьшается с её понижением. При повышении давления энтропия газа уменьшается, а при понижении – увеличивается. Из изложенного выше ясно, что энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при расширении газов, при химических взаимодействиях, приводящих к увеличению числа частиц и особенно частиц в газообразном состоянии. Напротив, все процессы, в результате которых упорядоченность системы возрастает (конденсация, полимеризация, сжатие, уменьшение числа частиц) сопровождаются уменьшением энтропии.
Энергия Гиббса - это изобарно-изотермический потенциал; критерий самопроизвольного протекания химической реакции. Химическая реакция принципиально возможна, если DG < 0. Стандартную энергию Гиббса рассчитывают по первому следствию из закона Гесса, так как DG является термодинамической функцией состояния системы.

По приведенному уравнению удобно вычислять стандартную величину изменения энергии Гиббса 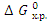 при 298 К, поскольку значения стандартных энергий Гиббса образования химических соединений при Т = 298 К можно найти в таблицах термодинамических величин. Стандартные значения энергий Гиббса образования простых веществ равны нулю. Изменение энергии Гиббса при химической реакции может быть вычислено по уравнению
при 298 К, поскольку значения стандартных энергий Гиббса образования химических соединений при Т = 298 К можно найти в таблицах термодинамических величин. Стандартные значения энергий Гиббса образования простых веществ равны нулю. Изменение энергии Гиббса при химической реакции может быть вычислено по уравнению
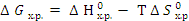 .
.
Если пренебречь изменениями ∆ Н 0 и ∆ S 0 с увеличением температуры, то можно определить температуру Травн, при которой устанавливается равновесие химической реакции (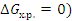 для стандартного состояния реагентов
для стандартного состояния реагентов
Травн = ∆ Н 0 / ∆ S 0.
При химических взаимодействиях одновременно изменяются энтальпия и энтропия системы, в связи с этим часто сопоставляют энтальпийный ∆Н и энтропийный Т∆S факторы химической реакции. Если тенденция к порядку и беспорядку в системе одинакова, то ∆Н0 = Т ∆S0, что является математическим условием равновесного состояния системы, из которого ее можно вывести только путем внешнего воздействия.
Возможность (или невозможность) самопроизвольного протекания реакции в зависимости от соотношения ∆H и ∆S приводит к следующим выводам:
1. Если ∆H<0 и ∆S>0, то ∆G<0, т.е. экзотермическая реакция с увеличением энтропии в системе возможна при всех температурах.
2. Если ∆H>0, а ∆S<0, то ∆G>0, т.е. эндотермическая реакция с уменьшением энтропии в системе невозможна ни при каких температурах.
3. Если ∆H<0 и ∆S<0, то знак ∆G экзотермической реакции с уменьшением энтропии зависит от соотношения ∆H и T∆S и возможна при достаточно низких температурах.
4. Если ∆H<0 и ∆S>0, то знак ∆G эндотермической реакции с увеличением энтропии в системе зависит от соотношения величин ∆H и T∆S; и реакция возможна при достаточно высоких температурах.
Пример 1. Пользуясь справочными данными, вычислить ∆Ho реакции:
2Mg(к) + CO2(г) ═ 2MgO(к) + C(графит)
Р е ш е н и е. По данным таблицы стандартные энтальпии образования CO2 и MgO равны соответственно -393,5 и -601,8 кДж/моль (напомним, что стандартные энтальпии образования простых веществ равны нулю). Отсюда для стандартной энтальпии реакции находим: ∆Ho ═ 2∆HoMgO - ∆HoCO2 ═ -601,8∙2 + 393,5 ═ -810,1 кДж
Пример 2. Рассчитайте энтропийный и энтальпийный факторы протекания процесса при стандартных состояниях и 298 К:
4 HCl (г) + O2 (г) = 2Cl2 (г) + 2 H2O(г).
Какой из рассчитанных факторов способствует самопроизвольному протеканию реакции в прямом направлении?
Решение.Используя следствие из закона Гесса, рассчитаем стандартную энтальпию и стандартную энтропию химической реакции:
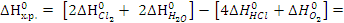
 ..
..
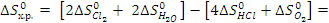
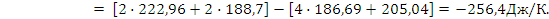 .
.
Самопроизвольному протеканию процесса способствует уменьшение энтальпии системы (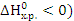 (кДж). Энтропийный фактор равен произведению абсолютной температуры на энтропию реакции, т.е
(кДж). Энтропийный фактор равен произведению абсолютной температуры на энтропию реакции, т.е 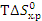 (кДж). Самопроизвольному протеканию процесса способствует рост энтропии
(кДж). Самопроизвольному протеканию процесса способствует рост энтропии  .
.
При расчете энтропийного фактора
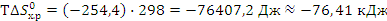
видно, что он не способствует самопроизвольному протеканию процесса.
Энтальпийный фактор 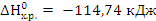 (
(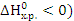 способствует самопроизвольному протеканию процесса в прямом направлении.
способствует самопроизвольному протеканию процесса в прямом направлении.
Пример 3. Установите, возможно ли восстановление оксида Fe(III) до свободного металла по уравнению Fe2O3(тв) + 3 H2 (г) = 2 Fe (тв) +3 H2O(г) при температуре 850 К. Зависимостью ∆Н0 и ∆S0 от температуры пренебречь.
Решение. Используя справочные данные приложения, определим энтальпию и энтропию химической реакции, воспользовавшись следствием из закона Гесса:  , где
, где 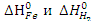 равны нулю.
равны нулю.
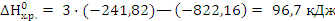
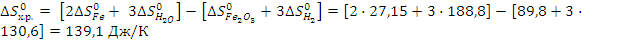 ..Энергия Гиббса химической реакции равна:
..Энергия Гиббса химической реакции равна:
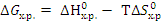 =96,7 · 103 - 850·139,1 = - 21,54· 103 кДж.
=96,7 · 103 - 850·139,1 = - 21,54· 103 кДж.
Восстановление оксида железа Fe(III) при температуре 850 К возможно, так как выполняется следующее условие DGх.р. < 0.
Пример 4. Не производя вычислений, определить знак изменения энтропии в следующих реакциях:
NH4NO3(к) ═ N2O(г) + 2H2O(г) (1)
2H2(г) + O2(г) ═ 2H2O(г) (2)
2H2(г) + O2(г) ═ 2H2O(ж) (3)
Р е ш е н и е. В реакции (1) 1моль вещества в кристаллическом состоянии образует 3моля газов, следовательно, ∆S1 >0. В реакциях (2) и (3) уменьшается как общее число молей, так и число молей газообразных веществ, так что ∆S 2 <0 и ∆S3<0. При этом ∆S3 имеет более отрицательное значение, чем ∆S2, так как SH2O(ж) < SH2O(г).
Пример 5. Определите энтропию ∆Sо реакции H2S(г) + Cl2(г) ═ 2HCl(г) + S(к)
Р е ш е н и е. Поскольку энтропия – функция состояния системы, то её изменение ∆Sох.р. в процессе химической реакции можно подсчитать, пользуясь следствием из закона Гесса: ∆Sох.р. ═ 2SоHCl + SоS(к) – (SоH2S + SоCl2 ).
Подставив соответствующие значения энтропии для каждого из веществ, взятые из таблицы, получаем:
∆Sох.р. ═ 2∙186,7 + 31,88 – 205,6 – 233 ═ - 23,32 Дж/К.
Задания для самостоятельного решения
Задача 4. (для ответов рекомендуется использовать справочный материал: Термодинамические характеристики некоторых веществ при 298 К)
Для вариантов 1…10 смотреть условия задачи в таблице.
1.Рассчитайте стандартную энтальпию и стандартную энтропию химической реакции.
2.Укажите, какой является реакция – эндотермической или экзотермической. Укажите, какой из факторов процесса, энтропийный или энтальпийный, способствует самопроизвольному протеканию процесса в прямом направлении.
3.Определите возможность протекания реакции при стандартных условиях, а также при температуре, указанной в таблице (столбец 3); (при решении зависимостью ∆Н0 и ∆S0 от температуры пренебречь).
4. Рассчитайте температуру, при которой равновероятны оба направления реакции.
| Номер варианта | Реакция | Т, К |
| 1. | 2 Н2S (г) + 3 O2 (г) = 2 SO2 (г) + 2H2O (г) | |
| 2. | CaO (тв) + CO2 (г) = CaCO3 (тв) | |
| 3. | 2 CuS (тв) + 3O2 (г) = 2 CuO (тв) + 2 SO2 (г) | |
| 4. | Fe3О4 (т) + 4H2 (г) = 3Fe(т) + 4Н2О | |
| 5. | 4 HCl (г) + O2(г) = 2 Cl2 (г) + 2 H2O(г) | |
| 6. | SO2 (г) + 2 H2(г) = S (тв) + 2H2O(г) | |
| 7. | 4 NH3 (г) +3 O2 (г) = 2 N2 (г) + 6 H2O(г) | |
| 8. | 4 NH3(г) + 5 O2 (г) = 4 NO (г) + 6 H2O (г) | |
| 9. | 4 FeS2(тв) + 11 O2 (г) = 2Fe2O3 (тв) + 8SO2 | |
| 10. | PbO (тв) + SO3(г) = PbSO4(тв) |
11. При восстановлении 2,1 г железа с серой выделяется 3,77 кДж тепла. Рассчитать энтальпию образования сульфида железа.
12. Определить стандартную энтальпию образования PH3, исходя из уравнения:
2РН3 + 4О2 = Р2О5(кр) + 3Н2О(ж); ∆ Н0 = -2360 кДж.
13. Исходя из уравнения реакции: СН3ОН(ж) = 3/2О2 = СО2 + 2Н2О(ж);
∆ Н0 = -726,5 кДж. вычислить энтальпию образования метилового спирта.
14. При восстановлении 12,7 г оксида меди (II) углем (с образованием СО) поглощается 8,24 кДж тепла. Определить энтальпию образования оксида меди.
15. Написать термохимическое уравнение реакции восстановления оксида хрома (III) алюминием. Сколько тепла выделится, если для реакции взять 1кг исходной смеси?
16. Вычислить тепловой эффект образования 200 кг серной кислоты по уравнению: SO3(ж) + Н2О(ж) = Н2SО4(ж).
17. Энтальпия образования метана равна -74,9 кДж/моль. Напишите термохимическое уравнение реакции сгорания метана, по которому вычислите, сколько тепла выделится при сгорании 200 л газа (н. у.).
18. При образовании 39,6 г оксида мышьяка (III) из простых веществ выделяется 131кДж тепла. Запишите термохимическое уравнение, вычислите энтальпию образования оксида мышьяка.
19 Реакция горения бензола протекает по уравнению:
С6Н6 +15/2 О2 = 6СО2 + 3Н2О(ж).
Какое количество тепла выделится при сгорании 1м3 бензола (н.у.)?
20.Напишите термохимическое уравнение растворения оксида меди (II) в соляной кислоте. Сколько тепла выделится при растворении 100 г оксида?
21. Вычислите сколько теплоты выделится при сгорании 112л СО, если реакция протекает по уравнению: 2 СО (г) + О2 (г) =2 СО2 (г)
22. Даны три уравнения химических реакций
Са(тв) + 2 Н2О (ж) = Са(ОН)2(водн) +Н2 (г) + 109 ккал
СаО(тв) +Н2О(ж) = Са(ОН)2 (водн) + +19,5 ккал
Н2(г) +½О2(г) =Н2О(ж) + 68,3 ккал
Определите тепловой эффект реакции Са(тв) + ½ О2(г) =СаО(тв) +Q
23. Определите теплоту образования аммиака, исходя из реакции
2NH3 (г) + 1,5О2 (г) = N2 (г) + 3 Н2О(ж); ∆Нх.р. = -766 кДж/моль
24. Какая из приведенных реакций протекает самопроизвольно. Ответ подтвердите расчетами. 2CuO (к) +4NO2(г) +О2(г) =2 Cu(NO3)2(к) Н2 (г) + Сl2 (г) = 2НСl (г)
25. Определите тепловой эффект реакции: 2 PbS + 3 O2 = 2 PbO + 2 SO2, зная стандартные значения энтальпии веществ (справочн).
26. По известным теплотам образования веществ (справочн) вычислите теплоту реакции
2 SO2(г) + O2(г) = 2 SO3(г)
27. Какой из отрезков на диаграмме соответствует тепловому эффекту реакции? Экзо- или эндотермическая реакция рассматривается на рисунке. Ответ поясните.

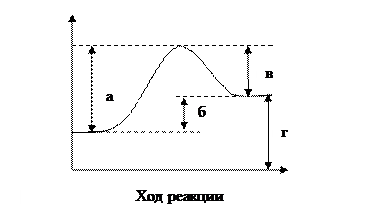
28. Определите теплоту перехода графита в алмаз, если известно, что теплота образования СО2 из графита равна -393,5 кДж/моль, а из алмаза -395,4кДж/моль
29. По известным теплотам образования веществ (справочн) вычислите теплоту реакции
Fe2O3 (к) +3С (графит) = 2 Fe (к) + 3СО(г)
30. Вычислите теплоту образования оксида меди (II), зная, что при восстановлении 40 г его углем образуется оксид углерода (II) и поглощается 10,92 кДж; ∆Н(СО) =-110кДж/моль
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 4208; Нарушение авторских прав?; Мы поможем в написании вашей работы!