
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции, идущие с образованием слабых электролитов
|
|
|
|
Растворы электролитов. Жидкие растворы делятся на растворы электролитов, способные проводить электрический ток, и растворы неэлектролитов, которые не проводят электрический ток. Процесс распада электролита на ионы под действием полярных молекул растворителя называется электролитической диссоциацией.
Тема 5. Растворы
Раствором называют гомогенную систему переменного состава, состоящую из двух или более компонентов. Вещества, составляющие раствор, называются компонентами раствора. Растворы бывают газообразные, жидкие и твёрдые. Любой раствор состоит из растворённых веществ и растворителя. Обычно растворителем считают тот компонент, который в растворе находится в том же виде, что и до растворения.
Свойства раствора определяются качественным и количественным составом раствора. На практике количественный состав растворов (концентрацию) обычно выражают при помощи следующих величин:
Молярная концентрация (М) - число молей растворённого вещества в 1 л раствора [моль/л].
Молярная концентрация эквивалента ( или нормальная концентрация (н)) – число молей эквивалентов растворённого вещества в 1 л раствора [г-экв/л].
Моляльность (m) – число молей растворённого вещества в 1000 г растворителя.
Молярная доля (cв) – отношение числа молей данного компонента к сумме молей всех компонентов раствора.
Массовая доля (w) – отношение массы растворённого вещества к массе всего раствора (в % - число граммов растворённого вещества в 100 г раствора).
Количественной характеристикой диссоциации является степень электролитической диссоциации α, которая равна отношению концентрации молекул, распавшихся на ионы С, к общей концентрации растворённого электролита Со:
α= 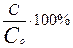 .
.
По величине α электролиты делятся на группы:
сильные с α>30%;
средние с 2%< α<30%
и слабые с α<2% (в 0,1 н растворах).
К сильным электролитам в водных растворах относятся практически все растворимые соли, щёлочи (основания s- элементов, кроме Be(OH)2 и Mg(OH) 2), неорганические кислоты, как HCl, HBr, HI, HNO3, H2SO4, HClO4 и т.д. К слабым электролитам в водных растворах принадлежат основания d-,f-, p- элементов, органические и большинство неорганических кислот, вода.
Истинная степень диссоциации сильных электролитов в растворах любой концентрации равна 100%. Однако, учитывая значительные силы межионного взаимодействия, понижающие активность ионов, вводят понятие активности сильных электролитов, т.е. условную (эффективную) концентрацию ионов, в соответствии с которой они действуют в химических процессах.
Для всех остальных электролитов электролитическая диссоциация является процессом обратимым:
KnAm ↔ nK+ + mA-
Кислоты можно охарактеризовать как электролиты, образующие при диссоциации в водных растворах в качестве катионов только ионы водорода, а основания – как электролиты, образующие в качестве анионов только гидроксид-ионы.
HNO3 ↔ H+ + 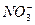
NaOH ↔ Na+ + OH- 
Многоосновные кислоты диссоциируют ступенчато:
1) H2SO4 ↔ H+ + 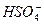
2) 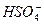 ↔ H+ +
↔ H+ + 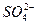 ,
,
причём по первой ступени степень диссоциации значительно больше, чем по второй.
Ступенчатая диссоциация характерна и для оснований, содержащих несколько гидроксильных групп в молекуле:
1) Mg(OH)2 ↔ MgOH+ + OH-
2) MgOH+ ↔ Mg2+ + OH-
При составлении ионных уравнений реакций формулы сильных электролитов записывают в диссоциированном виде. Слабые электролиты и труднорастворимые вещества в ионных уравнениях записывают в виде формул недиссоциированных молекул.
Каждая стадия характеризуется своей константой диссоциации. Связь между константами диссоциации и степенью диссоциации по соответствующей ступени выражается законом разбавления Оствальда:
Кдис = 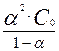 ;
;
или при α<<1, Кдис≈α2·Со.
Пример 1. Запишите выражение для констант диссоциации слабого основания Zn(OH) 2 по отдельным ступеням. По какой из ступеней диссоциация происходит сильнее?
Р е ш е н и е. Молекулы многоосновных кислот и оснований диссоциируют ступенчато, и каждая равновесная стадия процесса характеризуется своей константой равновесия – константой диссоциации:
1-я ступень Zn(OH) 2 ↔ ZnOH+ + OH-
Кд  =
= 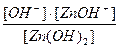
2-я ступень ZnOH+ ↔ Zn2+ + OH-
Кд 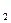 =
= 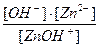
В результате 1-й ступени отрицательная частица ОН- отщепляется от нейтральной молекулы Zn(OH) 2, в результате второй ступени частица ОН- отщепляется уже от более положительного иона ZnOH+ , что, очевидно, требует гораздо большей затраты энергии. Поэтому количество ионов, образующихся по 2-й стадии будет значительно меньше, чем по 1-й, т.е. диссоциация протекает в меньшей степени. Этот качественный вывод подтверждается численными значениями соответствующих констант диссоциации (справ. данные: Кд1= 4,4∙10-5; Кд2= 1,5∙10-9; Кд1>> Кд2).
Ионное произведение воды. Вода, будучи очень слабым электролитом, в незначительной степени диссоциирует с образованием ионов водорода и гидроксид-ионов:
Н2О ↔ Н+ + ОН-
Этому процессу соответствует константа диссоциации:
К = 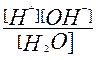
Это выражение можно преобразовать следующим образом:
[H+][OH-] = K[H2O] = KH2O = Kв = 10-14.
Kв есть величина постоянная для данной температуры и называется ионным произведением воды. При 25°С (298 К) Kв = 10-14.
В нейтральных растворах [H+] = [OH-] = 10-7 моль/л, в кислых растворах [H+] >[OH-], а в основных - [OH-] >[H+].
Водородный показатель среды рН. Вместо концентраций ионов H+ и OH- удобнее пользоваться их десятичными логарифмами, взятыми с обратным знаком; эти величины обозначаются символами рН и рОН и называются соответственно водородным и гидроксильным показателями:
рН = - lg[H+] pOH = - lg[OH-]
Логарифмируя соотношение [H+][OH-] = Kв и меняя знаки на обратные, получим:
рН + рОН = рКв.
В частности, при 25°С рН + рОН = 14. При этой температуре в нейтральных растворах рН=7, в кислых – рН<7, в щелочных – рН >7.
Пример 2. Концентрация ионов водорода в растворе равна 4∙10-3 моль/л. Определить рН раствора.
Р е ш е н и е. Округляя значение логарифма до 0,01 получим:
рН = - lg(4∙10-3) = -(- 3 + 0,60) = 2,40.
Пример 3. Определить концентрацию ионов водорода в растворе, рН которого равен 4,60.
Р е ш е н и е. Согласно условию задачи, - lg[H+] = 4,60. Следовательно,
lg[H+] = -4,60 = -5+ 0,40. Отсюда по таблице логарифмов находим:
[H+] = 2,50∙10-5 моль/л.
Пример 4. Чему равна концентрация гидроксид-ионов в растворе, рН которого равен 10,80?
Р е ш е н и е. Из соотношения рН + рОН = 14 находим:
рОН = 14 – рН = 14 – 10,80 = 3,20.
Отсюда - lg[OH-] = 3,20 или lg[OH-] = -3,20 = - 4 + 0,80.
Этому значению логарифма соответствует значение
[OH-] = 6,31∙10-4 моль/л.
При расчёте концентрации H+ учитывают, как правило, только первую ступень диссоциации слабого электролита.
Реакции в растворах электролитов сводятся к взаимодействию между ионами растворенных веществ. Данные реакции протекают только в том случае, если в результате электростатического взаимодействия между разноименно заряженными ионами образуются молекулы нового вещества: труднорастворимого, газообразного или малодиссоциированного (см. табл.4 Приложения).
Примером данного типа реакций является реакция нейтрализации. Процесс взаимодействия основания с кислотой, приводящий к образованию соли и воды, называется реакцией нейтрализации.
KOH + HNO3 = KNO3 + H2O
OH- + H+ = H2O
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1758; Нарушение авторских прав?; Мы поможем в написании вашей работы!