
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие
|
|
|
|
Влияние температуры на скорость химической реакции.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 10о градусов скорость химической реакции увеличивается в 2-4 раза (в γ раз):
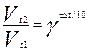 ,
,
где Vt2 и Vt1 –скорости реакции соответственно при температурах t2 и t1 ; γ - температурный коэффициент реакции и принимает значения для большинства реакций от 2 до 4.
Химические реакции, в результате которых исходные вещества полностью превращаются в продукты реакции, называются необратимыми. Реакции, идущие одновременно в двух противоположных направлениях (прямом и обратном), называются обратимыми.
Состояние системы в обратимых реакциях при равенстве скоростей прямой и обратной реакций (Vпр=Vобр) называется состоянием химического равновесия. Химическое равновесие является динамическим, т.е. его установление не означает прекращения реакции. В общем случае для любой обратимой реакции типа
aA + bB ↔ cC + dD
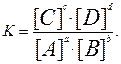
При установившемся равновесии произведение концентраций продуктов реакции, отнесённые к произведению концентраций исходных веществ для данной реакции при данной температуре представляет собой постоянную величину, называемую константой равновесия К.
Изменение условий (температура, давление, концентрация), при которых система находилась в состоянии химического равновесия (Vпр=Vобр), вызывает нарушение равновесия. В результате неодинакового изменения скоростей прямой и обратной реакции (Vпр≠ Vобр) с течением времени в системе устанавливается новое химическое равновесие (Vпр=Vобр), соответствующее новым условиям. Переход из одного равновесного состояния в другое называется сдвигом, или смещением положения равновесия.
Направление смещения химического равновесия в результате изменения внешних условий определяется принципом Ле Шателье: Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то оно будет способствовать протеканию того из двух противоположных процессов, который противодействует произведённому изменению.
Фазой называется совокупность однородных частей системы (т.е. одинаковых по физическим, химическим и термодинамическим свойствам), отделённая от других частей системы физической (реально существующей) поверхностью раздела. Все химические термодинамические системы можно разделить на две большие группы - гомогенные и гетерогенные. Гомогенными (однофазными) называют системы, состоящие только из одной фазы, например, воздух – смесь газов. Системы, содержащие две или более число фаз, называются гетерогенными (неоднородными, разнофазными). Например, не растворившиеся в воде кристаллы поваренной соли образуют гетерогенную систему из двух фаз. В гетерогенной системе составные её части – фазы – разделены поверхностью раздела.
Индивидуальное вещество в твёрдом агрегатном состоянии всегда образует самостоятельную фазу.
Жидкие и твёрдые фазы называются конденсированными.
Если вещество содержится одновременно в разных фазах, то происходит его переход из одной фазы в другую; такой переход называется фазовым. Состояние, при котором скорости противоположных фазовых переходов равны, называется фазовым равновесием.
Компонентами (составляющими веществами) называются все химические вещества, которые могут быть выделены из системы и существовать вне её. Число компонентов обозначают буквой R.
Число независимых компонентов (К) – это минимальное число компонентов, необходимое для образования каждой из фаз данной системы. Если в системе не протекает химическая реакция, то число независимых компонентов (К) равно числу компонентов (R): К= R.
Если же в системе между компонентами протекают химические реакции, то число независимых компонентов меньше числа компонентов: К<R, поскольку некоторые компоненты могут быть получены в ходе данных реакций.
Число независимых компонентов (К) равно числу компонентов (R) минус число математических уравнений, связывающих концентрации компонентов.
Например, система состоит из трех газов: оксида углерода (II), кислорода и оксида углерода (IV), связанных химическим процессом:
2СО + О2 = 2СО2.
Уравнением, связывающим концентрации компонентов в данной системе, является константа равновесия данной реакции:
Кр = 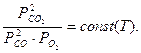
К = R – 1 = 3 – 1 =2
Таким образом, чтобы получить данную систему, в произвольном количестве можно взять только два газа: СО и О2, СО и СО2, СО2 и О2; количество третьего газа определяется константой равновесия.
Числом термодинамических степеней свободы (С) называется число параметров (температура, давление, концентрация независимых компонентов), которые можно произвольно в определенных пределах изменять, не меняя числа и вида фаз в системе.
Число степеней свободы можно рассчитать, пользуясь правилом фаз Гиббса:
С = К – Ф + n,
где К – число независимых компонентов; Ф –число фаз; n – число внешних параметров, влияющих на состояние фазового равновесия. Такими внешними параметрами являются температура и давление. Если Р и Т – величины переменные, то n = 2. При P=const или Т = const n = 1. Если и Р = const и Т = const, то n = 0.
Если С=0, то система называется инвариантной (безвариантной). Если С = 1, то система называется моновариантной. Если С = 2, то система называется бивариантной.
Правило фаз Гиббса дает возможность вычислить максимальное число фаз, которые могут находиться в равновесии:
Ф = К + n – С.
Число фаз достигает максимального значения, когда С = 0:
Фmax = К + n - 0.
В однокомпонентной системе (К = 1) максимальное число фаз, находящихся в равновесии, равно трем:
Фmax = 1 + 2 =3,
в двухкомпонентной - Фmax = 2 + 2 = 4, в трехкомпонентной - Фmax = 3 + 2 =5 и т.д.
Пример 1. Как изменится скорость реакции 2NO(г) + Cl2(г) ↔ 2NOCl(г) , если: а) увеличить давление в реакционном сосуде в два раза; б) уменьшить объём сосуда в 4 раза?
Р е ш е н и е.
а) В соответствии с законом действующих масс, скорость данной реакции описывается уравнением: V=k∙[NO]2 ∙[Cl]2. Поскольку увеличение давления приводит к пропорциональному увеличению концентраций газообразных веществ, концентрации реагентов в новых условиях будут равны: [NO]кон=2[NO]нач , [Cl2] кон=2[Cl2]нач . Константа скорости реакции при увеличении давления не изменяется, и скорость реакции в новых условиях будет равна:
Vкон= k∙[NO] 2 кон∙[Cl2]кон = k∙(2[NO])2нач∙(2[Cl2]нач) = 8∙k∙ [NO]2нач∙[Cl2]нач.
Отсюда следует, что
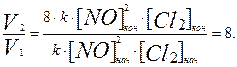
Скорость реакции увеличится в 8 раз.
б) Уменьшение объёма сосуда в 4 раза приводит к соответствующему увеличению концентрации реагентов. Таким образом, [NO]кон=4∙[NO]нач, а [Cl2]кон=4∙[Cl2]нач. Решая задачу по аналогии с предыдущим пунктом, получим 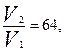 т.е. уменьшение объёма сосуда в 4 раза приведёт к увеличению скорости в 64 раза.
т.е. уменьшение объёма сосуда в 4 раза приведёт к увеличению скорости в 64 раза.
Пример 2. Температурный коэффициент скорости химической реакции равен 2,1. Во сколько раз возрастёт скорость реакции при увеличении температуры в реакционном сосуде с 15 до 38оС?
Р е ш е н и е. В соответствии с правилом Вант-Гоффа:
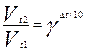 ;
; 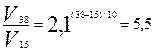 .
.
Пример 3. В какую сторону сместится химическое равновесие в системе
CaCO3(к) ↔ CaO(к) + CO2(г); ∆H=178,4 кДж/моль
а) при введении в систему углекислого газа;
б) при введении в систему оксида кальция;
в) при увеличении давления;
г) при увеличении температуры?
Р е ш е н и е. В соответствии с принципом Ле Шателье, равновесие в системе сдвигается таким образом, чтобы уменьшить внешнее воздействие.
а) Введение углекислого газа приводит к повышению концентрации СО2. Для ослабления этого воздействия равновесие в системе должно сместиться влево.
б) Введение твёрдого оксида кальция не изменяет концентрацию CaO в фазе CaO(к), и химическое равновесие не смещается.
в) Увеличение давления приводит к увеличению концентрации CO2(г) и практически не влияет на концентрацию твёрдых компонентов. Равновесие сдвигается влево.
г) Увеличение температуры может быть скомпенсировано эндотермическим процессом. Поскольку именно прямая реакция протекает с поглощением тепла, равновесие в системе смещается вправо.
Задания для самостоятельного решения
Задача 5.
| Номер варианта | Условие задачи |
| Рассчитайте, как изменится скорость реакции А(г) + 2В(г) → АВ2(г), если: а) увеличить концентрацию вещества А в 2раза; б) увеличить концентрацию вещества В в 2 раза? | |
| Напишите константу равновесия реакции2 S(к) + 2 Н2О(г) =О2(г) +2 Н2S(г). В какую сторону сместиться равновесие при увеличении давления в системе? Как изменится скорость реакции при уменьшении давления в системе в 2 раза? | |
| В реакторе объемом 50л помещено 72г Н2О и 84г СО. После нагревания до некоторой температуры в системе возникло равновесие Н2О (г) + СО (г) = Н2 (г) +СО2(г), а количество СО2 составило 44г. Рассчитайте константу равновесия Кр. | |
| Напишите константу равновесия реакции 2Н2(г) + СО (г) = СН3ОН (г). Назовите условия для смещения равновесия в сторону прямой реакции. Как изменится скорость реакции при увеличении давления в системе в 2 раза? | |
| При взаимодействии оксида углерода (II) с хлором исходная концентрация хлора равнялась концентрации оксида углерода (II): 0,1 моль/л. Через некоторое время она стала равной 0,04 моль/л. Во сколько раз уменьшилась скорость реакции к концу этого промежутка времени? | |
| Напишите константу равновесия реакции N2O4 (г) = 2NO2 (г); ∆Нх.р. =+58,4 кДж. В какую сторону сместиться равновесие при понижении температуры? Как изменится скорость реакции при увеличении объема системы в 3 раза? | |
| Выведите константу равновесия для обратимой реакции: Fe2O3 (к) +СО (г) = 2 FeO(к) +СО2(г). Найдите равновесные концентрации [СО]равн и [CO2]равн, если в реактор объемом 20 л было введено 10 моль СО, а константа равновесия при 10000С равна 0,5 | |
| Напишите константу равновесия реакции Н2 (г) + F2 (г) = 2HF(г). Назовите условия для смещения равновесия в сторону прямой реакции. Как изменится скорость реакции при увеличении давления в системе в 4 раза? | |
| При некоторой температуре в реакторе объемом 20 л установилось равновесие 2HBr(г) = H2(г) + Br2(г) с Кр=1,13. Определите количество разложившегося HBr, если в начале реакции в реактор было помещено 162г HBr. | |
| Некоторая реакция проводится при 500С, принимая температурный коэффициент скорости реакции равным 2,5; рассчитайте до какой температуры нужно понизить систему, чтобы скорость реакции уменьшилась в 10 раз | |
| В какую сторону сместиться химическое равновесие реакции N2 + 2 O2 = 2NO2 + Q; если увеличить давление и температуру? Как изменится скорость реакции при увеличении температуры на 20 0С? (Температурный коэффициент скорости прямой реакции равен 2, а обратной 3). | |
| В реакции N2(г) +3 H2(г) = 2 NH3(г), в состоянии равновесия концентрации веществ были следующие: N2=0,1 моль/л; Н2=0,3 моль/л; NH3 =0,4 моль/л. Вычислите исходные концентрации азота и водорода. | |
| Напишите константу равновесия реакции СНСl3 (г) +Сl2(г)= ССl4(г) + HCl(г). В какую сторону сместиться равновесие при удалении СCl4? К ак изменится скорость реакции при увеличении концентрации исходных веществ в системе в 4 раза. | |
| Номер варианта | Условие задачи |
| Чему равна средняя скорость реакции А+В=С, если начальная концентрация вещества В составляла 0,84 моль/л; а через 20с стала равной 0,62 моль/л? | |
| Для реакции Н2 + Сl2 = 2НСl константа равновесия равна 4. Определите равновесные концентрации веществ, если исходные концентрации Н2 и Сl2 соответственно равны 5 моль/л; 4 моль/л. | |
| Напишите константу равновесия реакции 2SO2 (г) + O2 (г) = 2 SO3(г), ∆Нх.р. = - 196,6 кДж. В какую сторону сместиться равновесие при повышении температуры и давления в системе? Как изменится скорость реакции при понижении давления в системе в 3 раза? | |
| При некоторой температуре в гомогенной системе АВ = А + В установилось равновесие с Кр= 0,03. Определите равновесные концентрации, если в начале реакции в реакторе объемом 10л находилось 5 моль АВ. | |
| Напишите константу равновесия реакции 2НBr (г) =H2 (г) +Br2 (г), ∆Нх.р = +72,5 кДж. Назовите условия для смещения равновесия реакции в сторону прямой реакции. Как изменится скорость реакции при увеличении давления в системе в 3 раза? | |
| Система, состоящаяиз водного раствора сульфата натрия, кристаллов этой соли и водяного пара, находится при постоянном давлении. Сколько степеней свободы имеет данная система? | |
| Во сколько раз следует увеличить концентрацию вещества А2 в системе 2А2(г) + В2(г) = 2А2В(г), чтобы скорость прямой реакции увеличилась в 16 раз? | |
| Напишите выражение константы равновесия реакции: Na2S2O3(ж) +H2SO4(ж) = Na2SO4(ж) + H2SO4(ж) + H2SO3(ж) + S(тв). Как изменится скорость реакции, если регулирующую смесь разбавить в два раза? | |
| Для некоторой температуры константа равновесия реакции СО + Н2О = СО2 + Н2 равна единице. Вычислите равновесные концентрации веществ в момент равновесия, если исходные концентрации СО и Н2О соответственно равны 0,1 и 0,4 моль/л. | |
| Вычислить число степеней свободы, которыми обладает система, состоящая из раствора KNO3 и NaNO3 в присутствии кристаллов обеих солей и паров воды. | |
| Температурный коэффициент скорости реакции равен 2,1. Рассчитайте, как изменится скорость реакции, если: а) увеличить температуру в системе с 18ºС до 43ºС; б) уменьшить температуру в системе с 55ºС до 8ºС? | |
| При некоторой температуре в системе PCl3(г) + Cl2(г) = PCl5(г) в системе установилось равновесие: [ Cl2 ] =0,01 моль/л; [ PCl3 ]= 0,02 моль/л; [ PCl5 ] = 0,02 моль/л. Какими будут равновесные концентрации, если концентрацию хлора увеличить до 0,05 моль/л? | |
| Рассчитайте, как изменится скорость реакции 2А(г) + В(г) → 2С(г), если: а) увеличить концентрацию вещества А в 2раза; б) увеличить концентрацию вещества В в 2 раза? | |
| В сосуде объемом 10 л находится 12,8г йодоводорода. После нагревания до некоторой температуры по реакции 2HI(г) = H2(г) + I2(г) образовалось 5,12г йода. Рассчитайте константу равновесия Кр. | |
| Определите число фаз, число компонентов и число степеней свободы для равновесной системы, содержащей ZnO(к), Zn(г), C(к), CO(г). | |
| Напишите константу равновесия реакции PCl5(г) = PCl3(г) + Cl2(г); ∆Hх.р = 92,45 кДж. В какую сторону сместиться равновесие при повышении температуры в | |
| Номер варианта | Условие задачи |
| системе, при увеличении концентрации PCl5? Как изменится скорость реакции при увеличении концентрации PCl5 в 3 раза? | |
| Во сколько раз следует увеличить концентрацию вещества В2 в системе 2А2(г) + В2(г) = 2А2В(г), чтобы при уменьшении концентрации вещества А в 4 раза скорость прямой реакции не изменилась? |
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 761; Нарушение авторских прав?; Мы поможем в написании вашей работы!