
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции, идущие с образованием труднорастворимого вещества
|
|
|
|
Реакции, идущие с образованием газообразного вещества
К данному типу реакций относятся в основном реакции, сопровождающиеся выделением водородных соединений неметаллов H2S, HF, HCl, HI, NH3 и др., например
ZnS + 2HCl = ZnCl2 + H2S↑
или в ионном виде:
ZnS + 2H+ = Zn2+ + H2S↑
Поскольку сульфид цинка плохо растворим в воде, то в ионном уравнении реакции эту соль записывают в молекулярной форме.
Значительно чаще происходят реакции, сопровождающиеся образованием труднорастворимых веществ, которые удаляются из сферы реакции в виде осадка, например:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
или ионное уравнение реакции:
Сa2+ + CO  =CaCO3↓
=CaCO3↓
Малорастворимые электролиты. Важной количественной характеристикой растворов является растворимость Ср. Она численно равна концентрации насыщенного раствора при данной температуре и выражается в г растворённого вещества на 100 г растворителя или в моль/л.
В насыщенных растворах малорастворимых сильных электролитов произведение активностей ионов этих электролитов в степенях их стехиометрических коэффициентов есть величина постоянная для данной температуры и называется произведением растворимости ПР. В случае разбавленных растворов электролитов можно принять величину активности практически равной величине концентрации. Тогда для электролита
АnBm → nAm+ + mBn-.
ПР = [nAm+]n[mBn-]m.
Растворимость вещества С р связана с ПР соотношением:
Ср = 
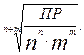

Таким образом, зная ПР, можно рассчитать растворимость и наоборот. Используя справочные величины ПР (табл. 3 Приложения), можно определить, возможно ли приготовить раствор заданной концентрации.
Пример 5. Произведение растворимости иодида свинца при 20°С равно 8∙10-9. Вычислить растворимость соли (в моль/л и г/л) при указанной температуре.
Р е ш е н и е. Обозначим искомую растворимость через s (моль/л). Тогда в насыщенном растворе PbI2 содержится s моль/л ионов Pb2+ и 2s моль/л ионов I-. Отсюда:
ПРPbI2 = [Pb2+][ I-]2 = s(2s)2 = 4s3
и
s = 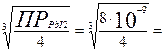 1,3 10-3 моль/л.
1,3 10-3 моль/л.
Поскольку мольная масса PbI2 равна 461 г/моль, то растворимость PbI2, выраженная в г/л, составит 1,3∙10-3 ∙461 = 0,6 г/л.
В химически чистой воде концентрация ионов водорода и гидроксид-ионов одинакова, поэтому вода имеет нейтральную реакцию (рН=7). При растворении многих солей в воде их ионы, образующиеся в результате диссоциации, вступают во взаимодействие с ионами воды, при этом происходит связывание ионов H+ или OH- ионами соли с образованием малодиссоциирующих соединений.
Процесс взаимодействия ионов растворенной соли с водой, приводящий к образованию слабых электролитов, называется гидролизом соли.
В результате гидролиза смещается равновесие электролитической диссоциации воды: Н2О ↔ Н+ + ОН-, поэтому растворы большинства солей имеют кислую или щелочную реакцию. различают три случая гидролиза солей:
1. Соли, образованные сильным основанием и слабой кислотой (например, KCN, K2SO3, CH3COONa, Na2S и др.). Гидролиз этих солей обусловлен связыванием ионов водорода в слабый электролит. Например, гидролиз ацетата натрия можно записать в виде следующего молекулярного уравнения:
CH3COONa + Н2О ↔ CH3COOН + NaOH
Или в ионном виде:
CH3COO- + НОН ↔ CH3COOН + ОН- (рН > 7)
Соли, образованные сильным основанием и многоосновной кислотой, гидролизуются ступенчато, с образованием кислых солей; например, гидролиз карбоната калия.
Первая ступень:
К2СО3 + Н2О ↔ КНСО3 + КОН
СО  + НОН ↔ НСО
+ НОН ↔ НСО 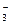 + ОН- (рН > 7)
+ ОН- (рН > 7)
Вторая ступень:
КНСО3 + Н2О ↔ Н2СО3 + КОН
НСО 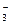 + НОН ↔ Н2СО3 + ОН- (рН > 7)
+ НОН ↔ Н2СО3 + ОН- (рН > 7)
Более сильно выражен гидролиз по первой ступени.
Растворы солей, образованных сильным основанием и слабой кислотой, имеют щелочную реакцию вследствие гидролиза (рН > 7).
2. Соли, образованные слабым основанием и сильной кислотой (например, NH4Cl, CuSO4, ZnCl2 и др.). Гидролиз этих солей обусловлен связыванием гидроксид-ионов воды в слабый электролит.
В результате гидролиза хлорида аммония ионы ОН- связываются ионами NH 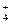 в малодиссоциированные молекулы NH4OH, при этом в растворе накапливается избыток ионов водорода, и реакция раствора становится кислой (рН < 7):
в малодиссоциированные молекулы NH4OH, при этом в растворе накапливается избыток ионов водорода, и реакция раствора становится кислой (рН < 7):
NH4Cl + Н2О ↔ NH4OH + HCl
NH 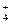 + НОН ↔ NH4OH + H+ (рН < 7)
+ НОН ↔ NH4OH + H+ (рН < 7)
Если соль образована многозарядным катионом, то гидролиз протекает ступенчато, с образованием основных солей.
Растворы солей, образованные слабым основанием и сильной кислотой, имеют кислую реакцию вследствие гидролиза (рН < 7).
3. Соли, образованные слабой кислотой и слабым основанием. Соли такого типа гидролизуются в наиболее высокой степени, так как их ионы одновременно связывают ионы водорода и гидроксид-ионы воды, сдвигая равновесие диссоциации воды. Например, гидролиз ацетата аммония можно представить следующим уравнением:
CH3COONH4 + H2O ↔ CH3COOH + NH4OH
или в ионном виде:
CH3COO- + NH 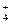 + HOH ↔ CH3COOH + NH4OH
+ HOH ↔ CH3COOH + NH4OH
В зависимости от соотношения констант диссоциации, образующихся в результате гидролиза кислоты и основания, растворы солей этого типа могут иметь слабокислую или слабощелочную реакцию, т.е. рН близко к 7.
Задания для самостоятельного решения
Задача 6.
1. Из четырех веществ номера вашего варианта (см. столбцы 1-4) выберите сильные и слабые электролиты и составьте уравнения диссоциации их в водном растворе
2. В столбце 1а даны значения молярных концентраций для растворов электролитов из столбца 1. Зная молярную концентрацию своего раствора, определите массовую долю вещества, принимая плотность раствора равной 1г/см3.
3. В столбце 3 приведены малорастворимые электролиты. Напишите выражение для ПР малорастворимого электролита номера вашей задачи. Вычислите, какое количество соли (в граммах) может раствориться в воде объемом 1 л.
4. Напишите уравнение гидролиза соли, данной в столбце 4. Предложите условия для уменьшения скорости реакции гидролиза.
5. Рассчитайте величину рН и рОН раствора, зная величину концентрации ионов Н+ (столбец 5).
| Номер варианта | Наименование вещества | Концентрация вещества, моль/л | Концентрация [H+], моль/л | ||||
| 1а | |||||||
| CsOH | H2C2O4 | SrSO4 | Na2SO3 | 0,002 | 10-4 | ||
| HBr | HOBr | AgI | Na3BO3 | 0,005 | 3,2∙10-6 | ||
| Sr(OH)2 | H3BO3 | MnS | K2S | 0,001 | 7,4∙10-11 | ||
| RbOH | НРО3 | PbI2 | Pb(NO3)2 | 0,009 | 10-3 | ||
| CsOH | H2CrO4 | PbCl2 | Al2(SO4)3 | 0,01 | 6,5∙10-8 | ||
| Н2SO4 | NH4OH | BaCrO4 | NaNO2 | 0,005 | 1,4∙10-12 | ||
| LiOH | Н3РО4 | Са3(РО4)2 | HCOOLi | 0,008 | 2∙10-7 | ||
| HI | Н2SO3 | СаСО3 | Na2SiO3 | 0,002 | 8,1∙10-3 | ||
| Вa(OH)2 | HCN | СаSO4 | K2SO3 | 0,005 | 2,7∙10-10 | ||
| HClO4 | NH4OH | MgCO3 | (NH4)2SO4 | 0,01 | 4,6∙10-4 | ||
| HCl | H2Se | Ag2SO4 | Na2CO3 | 0,006 | 10-5 | ||
| NaOH | H2SiO3 | BaSO4 | FeCl2 | 0,007 | 4,2∙10-6 | ||
| KOH | HNO2 | Ag2CrO4 | Ba(NO2)2 | 0,07 | 9,4∙10-9 | ||
| HNO3 | HAlO2 | FeS | KNO2 | 0,09 | 10-5 | ||
| HClO4 | HOCl | NiS | Сa(NO2)2 | 0,02 | 9,5∙10-6 | ||
| LiOH | H2CO3 | Ag3PO4 | Na2S | 0,05 | 10,4∙10-12 | ||
| Sr(OH)2 | H2SeO3 | ZnS | AlCl3 | 0,008 | 3,2∙10-7 | ||
| HI | HF | CaF2 | К2СО3 | 0,02 | 8,1∙10-2 | ||
| KOH | H2S | BaCO3 | NH4Cl | 0,05 | 2,7∙10-9 | ||
| Ba(OH)2 | H3PO4 | PbSO4 | СrBr3 | 0,006 | 4,6∙10-5 | ||
| CsOH | H2SO3 | Sr3(PO4)2 | Zn(NO3)2 | 0,001 | 10-11 | ||
| NaOH | HCN | FeCO3 | NiSO4 | 0,006 | 23,2∙10-3 | ||
| H2SO4 | HAlO2 | СdS | NaHCO3 | 0,003 | 15,4∙10-10 | ||
| HBr | HMnO4 | СoSO3 | Al2(SO4)3 | 0,02 | 10-12 | ||
| RbOH | HF | MgF2 | NH4Br | 0,009 | 6,5∙10-5 | ||
| Номер варианта | Наименование вещества | Концентрация вещества, моль/л | Концентрация [H+], моль/л | ||||
| NaOH | HOCl | SrSO4 | Ni(NO2)2 | 0,01 | 1,4∙10-13 | ||
| LiOH | H3BO3 | AgI | Сu(СN)2 | 0,007 | 3,2∙10-7 | ||
| HCl | H2TeO3 | Сa3(PO4)2 | K2Se | 0,04 | 9,1∙10-4 | ||
| HClO4 | H2Te | AgBr | Na2Te | 0,008 | 2,7∙10-11 | ||
| HNO3 | NH4OH | PbCl2 | KCN | 0,02 | 54,6∙10-4 | ||
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1898; Нарушение авторских прав?; Мы поможем в написании вашей работы!