
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок выполнения работы. Изучить влияние агрессивной среды, природы и концентрации примесей на величину электрохимической коррозии цинка в серной кислоте
|
|
|
|
Приборы и реактивы
Задачи
Работа №2
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ С ВОДОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ
Цель
Изучить влияние агрессивной среды, природы и концентрации примесей на величину электрохимической коррозии цинка в серной кислоте.
В качестве примесей, содержащихся в агрессивной среде, в работе взяты сульфаты металлов, имеющих более положительный потенциал, чем цинк. При контакте таких растворов с цинком происходит реакция цементации
Me2+ + Zn -> Zn2+ + Me
Выделяющийся при этом на цинковом образце металл образует катодные участки микроэлементов.
1. Построить графики зависимости объёма выделившегося водорода от времени в координатах V – t.
2. Определить угловой коэффициент получаемых прямых dV/dt, л/с 3. Рассчитать линейную скорость коррозии j в разных электролитах.
4. Рассчитать значения коэффициентов ускорения коррозии в присутствии растворов разных электролитов.
5. Сравнить скорость коррозии с величинами перенапряжения выделения водорода на соответствующих металлах-примесях.
1.Три бюретки на 50 мл для сбора газа, три воронки и три пробирки, соединенных резиновыми трубками с бюретками (см. рис. 6.2). Бюретки и воронки наполнены дистиллированной водой.
2.Три стакана на 100 мл.
3. Секундомер или часы.
4. Цинковые образцы.
5.Растворы солей H2SO4, CuSO4, FeSO4, PbSO4, NiSO4, CdSO4, CoSO4, SnSO4 (концентрации от 0.001 до 1.0 N).
Для проведения опыта необходимо:
1. Проверить приборы на герметичность. Для этого нужно переместить воронку (не снимая пробирки) на несколько больших делений бюретки вниз и закрепить её (см. рис. 6.2 б). Если прибор герметичен, уровень воды в бюретке окажется постоянным. Непрерывное понижение уровня воды в бюретке означает, что прибором пользоваться нельзя. В этом случае следует устранить негерметичность прибора с помощью лаборанта.
2. Приготовить электролит в стаканах. Использовать растворы трех любых солей (концентрации солей 0.05-0.01 N) и серной кислоты (концентрации кислоты 0.001-1.0 N). Количество агрессивной жидкости составляет 20 мл на 1 см2 поверхности образца металла. Состав электролита указывается преподавателем.
3. Снять пробирку и, передвигая воронку, установить уровень воды в бюретке на делении «0».
4. Отмерить градуированной пробиркой 5 мл раствора электролита, поместить металл и электролит в пробирку, плотно закрыть пробирку пробкой и включить секундомер.
5. Наблюдать выделение Н2, сопровождающееся вытеснением Н2O из бюретки в воронку, отмечая при этом объём выделенного Н2 через определённые интервалы времени, указанные в таблице 6.1.
6. Записать показания барометра и термометра.
Таблица 6.1.
Кинетика коррозии в разных средах
| H2SO4 (0.001-1.0 N) | H2SO4+ CuSO4 (0.05-0.01 N) | H2SO4+FeSO4 (0.05-0.01 N) | |||
| t, сек | V, л | t, сек | V, л | t, сек | V, л |
| и т.д. | |||||
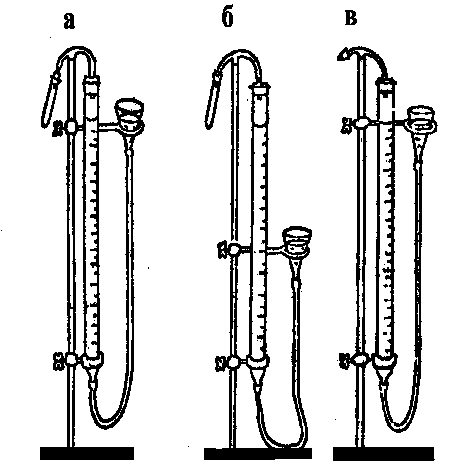 |
Рис. 6.2. Прибор для определения объёма выделившегося водорода
ОБРАБОТКА РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА
1.Построить графики зависимости объёма выделившегося водорода от времени в координатах V – t.
2.Определить угловой коэффициент получаемых прямых dV/dt, л/с (см. рис.6.3).
3.Рассчитать линейную скорость коррозии j по формуле:
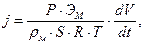 см/с
см/с
где Р – атмосферное давление, выраженное в атм (1 атм = 1,01· 105Па = 760 мм.рт.ст.); Эм – эквивалент металла, ρм – плотность металла (ρ Zn = 7.14 г/cм3), S – площадь образца, см2, R – универсальная газовая постоянная = 0.082 л·атм/моль·К, Т – абсолютное значение комнатной температуры.
4. Рассчитать значения коэффициентов ускорения коррозии по формуле
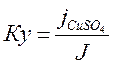
где j – скорость коррозии в серной кислоте, jСuSO4 – cкорость коррозии в присутствии CuSO4.
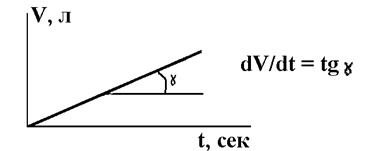 |
Рис. 6.3. Типичная зависимость V-t для коррозии металлов в кислоте
Полученные из опыта показатели коррозии интересно сопоставить с величинами перенапряжения выделения водорода на соответствующих металлах-примесях.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. Как происходит атмосферная коррозия луженого и оцинкованного
железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
2. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начнется бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
3. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
4. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
5. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
6. Железное изделие покрыли никелем. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводродной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
7. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний - никель. Какие продукты коррозии образуются в первом и во втором случаях?
8. В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
9. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
10. Какое покрытие металла называется анодным и какое - катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде.
11. Железное изделие покрыли кадмием. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и втором случаях?
12. Железное изделие покрыли свинцом. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и втором случаях?
13. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнений анодного и катодного процессов коррозии этих пластинок. Какой состав продуктов коррозии железа?
14. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Какой состав продуктов коррозии?.
15. Если опустить в разбавленную серную кислоту пластинку из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако если цинковой палочкой прикоснуться к железной пластинке, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте электронные уравнения анодного и катодного процессов.
16. Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
17. Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
18. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
19. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий - железо. Какие продукты коррозии образуются в первом и во втором случаях?
20. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
ЛИТЕРАТУРА
1. Архипова Н.В.Физическая химия / Н.В Архипова, В.В. Ефанова, В.В. Симаков. Саратов, РИЦ СГТУ, 2009. 160 с.
2. Архипова Н.В. Физическая химия гетерогенных систем / Н.В. Архипова, Е.П. Новожилов. Саратов, Изд-во СГТУ, 2010. 26 с.
3. Кругляков П.М. Физическая и коллоидная химия / П.М. Кругляков, Т.Н. Хаскова. М.: Высшая школа, 2007. 318 с.
4. Стромберг А.Г. Физическая химия / А.Г. Стромберг, Д.П. Семченко. М.: Высшая школа, 2001. 527с.
5. Михайлова А.М. Методическое указание «Диаграммы состояния двухкомпонентных систем» к лаб. работе по общей и физической химии / А.М. Михайлова, В.В. Ефанова, В.В. Симаков. Саратов. РИЦ СГТУ, 2001. 25 с.
6. Киреев В.А. Курс физической химии /В.А. Киреев. М.: Химия, 1978. 320 с.
7. Кубасов В.Л., Зарецкий С.А. Основы электрохимии/ В.Л. Кубасов., Зарецкий С.А. М.: Химия, 1976. 435 с.
8. Практикум по физической химии /под ред. С.В. Горбачева. М.: Высшая школа, 1974. 375 с.
9. Дулицкая Р.А. Практикум по физической и коллоидной химии/ Р.А. Дулицкая, Р.И. Фельдман. М.: Высшая школа, 1978. 340 с.
10. Сборник практических работ по физической и коллоидной химии /под ред. П.П. Токарева. Новосибирск, 1982. 355 с.
11. Практикум по электрохимии / Под ред. Б.Б. Дамаскина. М., 1991. 432 с.
12. Шаталов А.Я., Маршаков И.К. Практикум по физической химии / А.Я. Шаталов, И.К. Маршаков. М.: Высшая школа, 1975. 386 с.
13. Практикум по прикладной электрохимии: учебное пособие для вузов. / Н.Г. Бахчисарайцьян, Ю.В. Борисоглебский, Г.К. Буркат и др.; под ред. В.Н. Варыпаева, В.Н. Кудрявцева. Л.: Химия, 1990. 421 с.
14. Беленький М.А., Иванов А.Ф. Электроосаждение металлических покрытий: cправочник / М.А. Беленький, А.Ф. Иванов. М.: Металлургия, 1985. 542 с.
15. Жук Н. П. Курс теории коррозии и защиты металлов / Н.П. Жук, М. «Металлург», 1976. 335 с.
16. Дамаскин Б. Б, Петрий О. А. Теоретическая электрохимия / Б.Б. Дамаскин, О.А. Петрий, М., Высшая школа, 1984. 472 с.
17. Глинка Н. Л. Общая химия / Н.Л. Глинка, 24-е изд. Л.: Химия, 1985. 545 с.
18. Коровин Н. В. Общая химия / Н.В. Коровин, М.: Высшая школа, 2004. 560 с.
Приложение
Таблица
Стандартные потенциалы металлических н газовых электродов при 298 К
| Электродная реакция | E0, В | Электродная реакция | E0, В |
| Li+ + e- «Li | -3,04 | 2H+ + 2е- «H2 | 0,0 |
| К+ + e- «K | -2,92 | Cu2+ + 2е- «Cu | +0,34 |
| Са2+ + 2е- «Ca | -2,87 | О2 + 2Н2O + 4е- «4OH- | +0,401 |
| Na+ + е- «Na | -2,71 | Hg2+ + 2е- «Hg | +0,79 |
| Mg2+ + 2е- «Mg | -2,36 | Ag+ + е- «Ag | +0,80 |
| А13+ + 3е- «Al | -1,66 | Pd2+ + 2е- «Pd | +0,99 |
| Mn2+ + 2е- «Mn | -1,18 | Pt2+ + 2е- «Pt | +1,19 |
| Zn2+ + 2е- «Zn | -0,76 | Cl2 + 2е- «2Cl- | +1,36 |
| Fe2+ + 2е- «Fe | -0,44 | Au3+ + 3е- «Au | +1,50 |
| Cd2+ + 2е- «Cd | -0,40 | 2NO + 4H+ + 4е- «N2 + + 2H2O | +1,68 |
| Ni2+ + 2е- «Ni | -0.25 | ||
| Sn2+ + 2е- «Sn | -0,14 | Au+ + е- «Au | +1,69 |
| Pb2+ + 2е- «Pb | -0,13 | F2 + 2е- «2F- | +2,84 |
ОГЛАВЛЕНИЕ
| ВВЕДЕНИЕ | |
| 1.ОСНОВНЫЕ ПОНЯТИЯ ЭЛЕКТРОХИМИИ | |
| 2. СОСТАВЛЕНИЕ ОТЧЕТА. ОБРАБОТКА ДАННЫХ ЭКСПЕРИМЕНТА | |
| 3. ЭДС ХИМИЧЕСКИХ И КОНЦЕНТРАЦИОННЫХ ЭЛЕМЕНТОВ | |
| 3.1. Теоретическая часть | |
| 3.2. Экспериментальная часть | |
| Работа 1. Определение произведения растворимости малорастворимых солей | |
| Работа № 2. Определение значений водородного показателя (рН) ВОДНЫХ растворов | |
| Работа № 3. Определение среднего коэффициента активности электролита методом потенциометрии | |
| Работа № 4 ИЗУЧЕНИЕ РАБОТЫ И ИЗМЕРЕНИЕ ЭДС ГАЛЬВАНИЧЕСКОГО Cu/Ag ЭЛЕМЕНТА | |
| Работа № 5 ОПРЕДЕЛЕНИЕ ЧИСЕЛ ПЕРЕНОСА ИЗМЕРЕНИЕМ ЭДС КОНЦЕНТРАЦИОННОГО ЭЛЕМЕНТА | |
| Работа № 6 ИЗМЕРЕНИЕ ЭДС КОНЦЕНТРАЦИОННОГО ЭЛЕМЕНТА | |
| 4. ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ | |
| 4.1. Теоретическая часть | |
| 4.2. Экспериментальная часть | |
| Работа № 1 ОПРЕДЕЛЕНИЕ КОНСТАНТЫ И СТЕПЕНИ ДИССОЦИАЦИИ СЛАБОГО ЭЛЕКТРОЛИТА | |
| Работа № 2 ОПРЕДЕЛЕНИЕ РАСТВОРИМОСТИ И ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ МАЛОРАСТВОРИМОЙ СОЛИ- | |
| Работа № 3 ОПРЕДЕЛЕНИЕ СТЕПЕНИ ЗАГРЯЗНЕННОСТИ ОБРАЗЦОВ ВОДЫ | |
| 5. ЗАКОН ФАРАДЕЯ И ФАРАДЕЕВСКИЕ РЕАКЦИИ НА ЭЛЕКТРОДАХ | |
| 5.1. Теоретическая часть | |
| 5.2. Экспериментальная часть | |
| Работа № 1 ЭЛЕКТРОГРАВИМЕТРИЯ | |
| КОНТРОЛЬНЫЕ ЗАДАНИЯ | |
| 6. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. КОРРОЗИЯ | |
| 6.1. Теоретическая часть | |
| 6.2. Экспериментальная часть | |
| Работа 1 ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ | |
| Работа 2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ С ВОДОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ | |
| КОНТРОЛЬНЫЕ ЗАДАНИЯ | |
| ЛИТЕРАТУРА | |
| ПРИЛОЖЕНИЕ |
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 708; Нарушение авторских прав?; Мы поможем в написании вашей работы!