
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 13
|
|
|
|
Пример 12
Пример 11
К газу при круговом процессе подведено 270кДж теплоты. КПД равен 0,48.
Определить работу и количество теплоты, отданное теплоприёмнику.
| W -? Q2 -? | Используем формулы для КПД 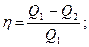 Q2 = Q1 - hQ1
Q1 – Q2 = W
Q2 = 270 – 0,48×270 = 140,4 (кДж)
W = 270 –140,4 = 129,6 (кДж)
Q2 = Q1 - hQ1
Q1 – Q2 = W
Q2 = 270 – 0,48×270 = 140,4 (кДж)
W = 270 –140,4 = 129,6 (кДж)
|
| Q1 = 270 кДж h = 0,48 |
Выяснить возможность протекания реакции при стандартных условиях
3С2Н2Г ® С6Н6Ж
| DGx -? | Используя формулу |
| DG°m(C6H6)жс = 124,38 кДж/моль DG°m(C2H2) = 209,21 кДж/моль | DG°x = åDG°m(прод) – åDG° m(исх), то есть DG°х = DG°m(C6H6)ж – 3·DG°m(C2H2)г Для этого воспользуемся справочной литературой и выпишем значения DG° m веществ по приложению 3. DG°x = 124–3∙209,21 = – 503,21 кДж< 0. Так как DG<0, то данная реакция при стандартных условиях протекать может. |
При низких температурах (стандартных условиях) окисление SO2 не происходит. Определить температуру, выше которой эта реакция может быть использована в химической технологии.
2SO2 г + О 2 ® 2SO 3г.
1) Данная реакция возможна, если DG£0 Þ для решения этой задачи используем формулу: DG°х=DH°х – T·DS° х £0 Þ DH° х £ T·DS° х
T ³ DH°х /DS° х
2) Определяем DН°х и DS°х при стандартных условиях, для этого используем справочную литературу приложение 3
DH°х = åDH° m (прод) – åDH° m (исх).
DS° х = åS° m (прод ) – åS° m (исх).
| Т -? | DH°х = (2×DН°m(SO3) – (2DH°m(SO2)+DH°m(O2)) |
| DН ° m(SO2)г = – 296,9 кДж/моль DН ° m(O2)г = 0 кДж/моль DН ° m(SO3)г = – 395,85 кДж/моль S ° m(SO2)г = 248,07 кДж/(моль×К) S ° m(O2)г = 205,04 кДж/(моль×К) S ° m(SO3)г = 256,69 кДж/(моль×К) | DS° х = 2·(S°m(SO3) – (2·S°m(SO2)+S°m(O2)) DH°х = (2×(– 395,85) – (2×(– 296,9 + 0) = – 197,9 кДж DS° х = 2×256,69 – (2×248,07+205,04) = – 187,8 Дж/К = = – 187,8×10-3 кДж/К Т ³ – 197,9/(– 187,8×10-3) = 1053,8 К. |
Вопросы для самоконтроля по теме «Основы термодинамики»
1.В адиабатическом реакторе непрерывного действия происходит изменение температуры, хотя она и не совершает работу. Как ведёт себя при этом внутренняя энергия?
2.Почему при таянии льда, несмотря на приток теплоты, температура системы остаётся постоянной?
3.Объясните различие между:
а) теплоёмкостью и теплотой;
б) законом Гесса и Первым законом термодинамики.
4.Объяснить причину остывания горячего тела, окружённого более холодной средой.
5.Как изменится энтропия в процессе кипения системы?
6.Проанализируйте процесс парообразования на Р-V; Т-S диаграммах воды.
Тема 1.3. Химическая кинетика
Данный раздел физической химии изучает скорость и механизм протекания химических реакций, зависимость влияния различных факторов на скорость протекания реакции.
Средняя скорость реакции υ рассчитывается по формуле:
υ = ±Dп/(VDt) = ±Dc/Dt = ± (c2 – c1)/(t2-t1)
п - количество вещества (моль);
V – объём (м3);
t (тау) – время (с);
c – концентрация (моль/м3).
Мгновенная или истинная скорость – первая производная концентрация по времени.
υ = ±dc/dt
Для реакции: аА + bB = cC + dD
Знак «+» - концентрацию веществ рассматривают по прибыли продуктов реакции (С+D).
Знак «-» - концентрацию рассматривают по убыли исходных веществ (А+B).
Скорость всегда положительна!
Основной закон кинетики – закон действия масс (впервые сформулирован в 1865г Бекетовым)
Для реакции: аА + bB = cC + dD
Скорость химической реакции при T=const прямо пропорциональна произведению молярных концентраций реагирующих веществ (парциальных давлений – для газов), взятых в степени, равной стехиометрическому коэффициенту соответствующего вещества в уравнении реакции.
υ = kСAa × СBb или υ = k[A]a×[B]b
Для газообразных веществ вместо концентраций используют парциальные давления
υ = kPAa × PBb
k – константа скорости реакции.
Константа скорости реакции зависит от природы веществ и температуры, не зависит от концентрации или давления
Химические реакции классифицируют:
1. по молекулярности;
2. по порядку реакций.
Общий кинетический порядок (n) реакции выражается суммой величин показателей степени при концентрации реагирующих веществ в кинетическом уравнении для скорости химической реакции.
Кинетическое уравнение – это математическая форма зависимости скорости от концентрации реагирующих веществ
0 £ n £ 3
1) Реакция нулевого порядка n = 0 υ = k 0 c°
Скорость постоянна во времени и не зависит от концентрации.
2) Реакция первого порядка n = 1 для реакции А ® продукты υ = k I [A]1
3) Реакции второго порядка n = 2 А + В ® продукты 2А ® продукты
υ = k II [A] 1 [B] 1 1+1 = 2 (второй порядок)
υ = k II [A] 2
4) Реакции третьего порядка n = 3
A + B + C ® продукты 2А + B ® продукты 3А ® продукты
υ = k III ×[A] 1 [B] 1 [C] 1 1+1+1 = 3 (третий порядок)
υ = k III× [A] 2 [B] 2+1 = 3 (третий порядок)
υ = k III ×[A] 3
Кинетический порядок определяется механизмом реакции.
Разберём кинетическое уравнение реакции первого порядка
А ® продукты
В начальный момент t = t0 концентрация [А] = а (максимальна)
По истечении времени t = t1 концентрация А уменьшается [A] = а – х.
х – уменьшение концентрации.
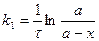 - кинетическое уравнение реакции 1-го порядка.
- кинетическое уравнение реакции 1-го порядка.
[k I ] = время – 1 (с- 1; ч- 1; сутки- 1 )
Период полураспада – это время, за которое прореагировало половина исходного вещества.
t 1/2 = ln 2/k I.
Кинетическое уравнение реакции 2-го порядка
А + В ® продукты
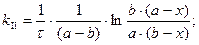
a, b – концентрации А, В в начальный момент времени
a – x, b – x - уменьшение концентраций А, В в ходе реакции.
В химическую реакцию вступают только активные молекулы (скорость их выше средней и обладающие большим запасом энергии).
Энергия, необходимая для перевода частиц 1 моль вещества из стабильного состояния в активное называется энергией активации Еакт (Дж).
Её определяют по формуле Аррениуса
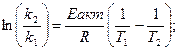
или преобразуя
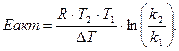
Влияние различных факторов на скорость реакции:
1. Природа реагирующих веществ;
2. Концентрация;
3. Катализатор;
4. Температура;
Влияние температуры выражается приближённым правилом Вант Гоффа:
При повышении температуры на 10°С при постоянном давлении скорость реакции возрастает 2 – 4 раза.
k 2 /k 1 = g (t2-t1)/10
g - температурный коэффициент скорости.
k 2 ,, k 1 – константы скорости реакции при температурах t2 и t1.
Прологарифмировав это уравнение, получаем следующую формулу Вант Гоффа:
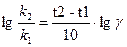
В условиях производства в реагирующей системе наряду с основной реакцией протекают побочные, приводящие к расходованию исходных веществ, но не дающие целевых продуктов. Для этого введём понятие селективность процесса Sпр
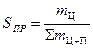
m Ц– масса целевого продукта
å m Ц+П– сумма масс всех продуктов реакции.
Примеры решения задач по теме «Химическая кинетика»
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 623; Нарушение авторских прав?; Мы поможем в написании вашей работы!