
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 1.4. Поверхностные явлении. Катализ
|
|
|
|
Катализ – это явление изменений скорости химической реакции в присутствии вещества.
Механизм катализа можно разделить на 5 частей:
1. Диффузия реагирующих веществ к поверхности катализатора
2. Адсорбция на поверхности катализатора
3. Химическая реакция
4. Десорбция
5. Диффузия продуктов от поверхности катализатора
Поэтому прежде, чем говорить о катализе рассмотрим процесс адсорбции.
На поверхности соприкосновения двух фаз идут процессы поглощения частиц одной фазы, другой фазой. Такой процесс называется сорбцией.
Процесс поглощения поверхностью одной фазы частиц из другой фазы называется адсорбцией.
Если поглощение идёт всей массой вещества или объёмом, то процесс называется абсорбцией.
Количественно адсорбция измеряется удельной адсорбцией ГS – это количество поглощаемого вещества (адсорбтива) единицей поверхности адсорбента (вещество, способное поглощать) или единица веса адсорбента:
ГS = п/S; моль/м2 ГS = п/m; моль/кг
п – количество адсорбтива
S – площадь адсорбента
m – масса адсорбента
Адсорбция зависит от:
1) природы адсорбента, адсорбтива
2) температуры
3) концентрации (давления для газа)
Термодинамическое описание адсорбционного равновесия (для систем жидкость-газ; жидкость-жидкость) даётся уравнением изотермы адсорбции Гиббса
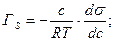
c – равновесная концентрация адсорбтива в среде.
ds/dc – изменение поверхностного натяжения (s).
1) если ds/dc < 0 Þ ГS > 0 – идёт процесс положительной адсорбции;
2) если ds/dc > 0 Þ ГS < 0 – отрицательная адсорбция – десорбция (вещество удаляется от поверхности адсорбента).
Для систем твёрдое тело – газ, твёрдое тело – жидкость удобно пользоваться уравнением изотермы адсорбции Лэнгмюра.
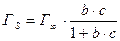 – для жидкостей;
– для жидкостей;
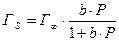 – для газов
– для газов
b – константа адсорбционного равновесия
Г ¥ - максимальная адсорбция
На процессах адсорбции основаны действия катализаторов.
Катализаторы – это вещества, которые увеличивают скорость реакции.
Катализ – это процесс, при котором скорость реакции изменяется.
Виды катализа: положительный, отрицательный, автокатализ, гомогенный, гетерогенный катализы:
Положительный катализ – это катализ, при котором скорость реакции увеличивается.
Отрицательный катализ – это катализ, при котором - скорость реакции уменьшается.
Автокатализ – это катализ, при котором катализатор возникает в процессе реакции.
Гомогенный катализ – это катализ, при котором катализатор и реагирующие вещества находятся в одной фазе.
Гетерогенный катализ – это катализ, при котором катализатор и реагирующие вещества находятся в различных фазах.
Особенности катализаторов.
1. Катализатор участвует в реакции, образует промежуточное соединение.
2. Катализатор снижает величину Е активации.
3. Количество катализатора << реагирующих веществ.
4. Катализатор одинаково ускоряет прямую и обратную реакцию.
5. Катализатор не изменяет величины теплового эффекта.
6. Катализаторы специфичны.
7. На катализатор влияют примеси - одни активируют (активаторы, промоторы), другие пассивируют (каталитические яды)
8. Катализаторы меняют механизм реакции.
Основные требования, предъявляемые к катализаторам.
1. Физическое и химическое сродство к реагентам.
2. Специфичность.
3. Избирательный характер - способность ускорять одну или несколько реакций из возможных химических процессов.
4. Селективность выражается в сравнении каталитических и некаталитических реакций.
5. Активность - оценивается по количеству целевого продукта, полученного с единицы массы или объема катализатора за единицу времени.
6. Способность к регенерации.
7. Доступность и экономичность.
8. Физически и химически устойчив.
9. Термическая стабильность.
10.Прочность.
Факторы, влияющие на активность катализаторов:
1) поверхность катализатора;
2) температура;
3) структура поверхности катализатора.
Катализатор характеризуется активностью Вk и селективностью Sk.
Вк = w1/w2; Вк = k1/k2
w1,w2 – скорости
k1,k2 – константы скорости реакции в отсутствии и в присутствии катализаторов.
Sk = mц/(mц+n); Sk = Vц/(Vц+n)
mц, Vц - масса, объём целевого продукта
mц+n, Vц+n – масса, объём всех веществ, образующихся в ходе реакции.
Вопросы для самоконтроля
1. В чём состоит сущность автокатализа, гомогенного, гетерогенного катализов?
2. Назовите особенности каталитических процессов.
3. Назовите пути повышения активности твёрдого катализатора.
Тема 1.5. Химическое равновесие.
Химические реакции протекают обратимо и необратимо.
 Обратимыми называются реакции, которые могут при одних и тех же условиях протекать в противоположных направлениях.
Обратимыми называются реакции, которые могут при одних и тех же условиях протекать в противоположных направлениях.
А + В  С + D.
С + D.
Необратимыми называются реакции, при которых образуются трудно растворимые осадки, либо выделяются газообразные продукты реакции.
А + В ® С + D¯; A + B ® C + D.
Пределом протекания обратимых реакций при данных условиях является достижение истинного химического равновесия.
Химическое равновесие характеризуется константой химического равновесия К.
Для реакции аА + bB 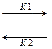 cC + dD.
cC + dD.

Такая константа химического равновесия обозначается КС, индекс С обозначает, что константа выражена через молярные концентрации

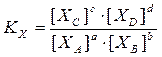 – константа химического равновесия, выраженная через молярные доли.
– константа химического равновесия, выраженная через молярные доли.
 – константа химического равновесия, выраженная через парциальные давления.
– константа химического равновесия, выраженная через парциальные давления.
Значение Константы.
1. К >> 1, то процесс протекает со значительным выходом продуктов.
2. К << 1, то выход продукта мал, процесс нетехнологичный, т.е нерентабельный для технологии применения.
3. К > 104 - реакцию считают необратимой.
К < 10-4 – реакции практически невозможны.
4. 104 > К > 10-4 – практически обратимы.
Существует другой критерий для определения характера протекания химического процесса. Если химический анализ указывают:
1) на отсутствие исходных веществ в равновесной химической системе, то реакция считается необратимой.
2) на наличие в равновесной системе, как исходных веществ, так и продуктов реакции, которую считают обратимой.
3) если в системе не обнаружилось продуктов реакции, то такая реакция считается практически невозможной.
Знание константы позволяет технологу определить состав равновесной системы, рассчитать выход продукта, вычесть коэффициент использования сырья и др. расчеты.
∕ ∕
\
H
КР >> 104 – протекает необратимо
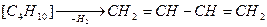
КР << 10-4 практически невозможно
Далее также будет говорить об использовании КР при выяснении влияния состава системы на направленность протекания процесса, т.е на химическое сродство.
Константа химического равновесия показывает во сколько раз скорость прямой реакции больше или меньше скорости обратной реакции.
Она зависит от природы реагирующих веществ и от температуры.
Взаимосвязь между КР, КС, КХ выражается следующими формулами:
КР = КС(RT)Dn = Кx(Pсм) D n, где
Dп = ånпрод - ånисх
Dп = (c + d) - (a + b) – учитывается количество вещества газообразных компонентов системы.
Химическое равновесие подвижно, то есть если изменить одно из условий, при котором система находится в равновесии, то произойдёт сдвиг равновесия вправо или влево, в сторону той реакции, которая противодействует этому изменению. Это соответствует принципу Ле-Шателье (1884 г).
Рассмотрим факторы, которые влияют на смещение равновесия на примере синтеза аммиака: 3Н2 + N2  2NH3 + Q
2NH3 + Q
1) Влияние температуры.
Прямая реакция экзотермическая, то есть с выделением теплоты +Qx Þ обратная реакция эндотермическая, идущая с поглощением теплоты системой из окружающей среды.
Если увеличить температуру равновесной химической системы (подвод тепла), то в системе начнётся процесс, направленный на уменьшение её t° (поглощения), и наоборот при уменьшении температуры начнётся процесс, направленный на увеличение температуры, отсюда вывод: увеличение Т смещает химическое равновесие в сторону эндотермической реакции, а уменьшение – в сторону экзотермической реакции.
2) Влияние давления.
3Н2 + N2  2NH3
2NH3
Вспомним, что в газообразных системах объём приравнивается количеству веществ, то есть реагируют 4 моль вещества, образуется 2 моль вещества.
Если увеличить Р, то в системе начнётся процесс, направленный на уменьшение Р путём уменьшения объёма (числа молей) газообразных веществ, и наоборот.
Вывод: увеличение Р смещает химическое равновесие в сторону той реакции, которая идёт с уменьшением числа моль вещества. Если уменьшить Р, то химическое равновесие сместится в сторону реакции, идущей с увеличением числа моль вещества.
3) Влияние концентрации.
Если в равновесную химическую систему добавить вещество, которое участвует в химической реакции, то в системе начнётся процесс, идущий на расходование этого вещества.
Например:
1.добавляем в систему H2 или N2, то равновесие сместится вправо – в сторону образования NH3, то есть идёт процесс расходования H2 или N2.
2.добавляем в систему NH3 – равновесие сместится влево – идёт процесс расходования NH3 с образованием H2 и N2.
Если удалить из системы какое-либо из взаимодействующих компонентов, то равновесие сместится в сторону реакции, направленной на образование дополнительного количества этого компонента.
Например:
1.если удалить из системы NH3, то равновесие системы сместиться в сторону реакции, направленной на образование этого вещества, то есть слева направо.
2.если уменьшить концентрацию H2 или N2, то есть удалить из системы, то равновесие сместиться справа налево (на образование дополнительного количества).
Итак, чтобы в реакции синтеза аммиака получить большой выход продукта (NH3), необходимо:
1. понизить Т;
2. увеличить давление;
3. увеличить концентрацию исходных веществ (H2 и N2), уменьшить концентрацию NH3, то есть удалять его в ходе синтеза из реакции.
Для того, чтобы совершалась химическая реакция, должна быть затрачена работа, которая идёт на увеличение свободной энергии образующихся веществ. Величина изменения свободной энергии (энергия Гиббса DG, энергия Гельмгольца DF) является мерой реакционной способности взаимодействующих веществ, а знак её указывает на направленность процесса.
Расчёты ведут по уравнениям изотермы химической реакции Вант Гоффа:
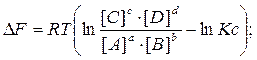
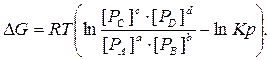
Кс, Kр – константы равновесия при абсолютной Т
[C],[D],[A],[B] – концентрации
РС, РD, PA, PB – парциальные давления
Если [C]=[D]=[B]=[A] = 1 моль/м3 Þ D F° = – RT ln KC; – D F° = RT ln KC
если [РС]=[РD]=[РB]=[РA]= 1Па Þ D G° = – RT ln Kр; – D G° = RT ln Kр
При самопроизвольном процессе D F, D G < 0; система совершает полезную работу
W = – D G = DпRT ln Kр
W = – D F = DпRT ln KC
Вспомним формулы из второго закона термодинамики, по которым можно рассчитать
D G°298 = D H°298 - T D S°298.
Константа химического равновесия зависит от температуры системы. Эта зависимость представлена в виде уравнения изобары Вант Гоффа.
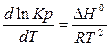
Если DН < 0 (экзотермическая реакция), то при увеличении температуры константа уменьшится Þ равновесие сместится в строну исходных веществ (справа налево).
Если DН > 0, то при увеличении температуры const увеличивается, равновесие сместится слева направо - в сторону продуктов реакции.
Если DН = 0. Константа не зависит от температуры.
Для расчётов удобнее пользоваться преобразованным уравнением изобары.
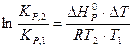
Примеры решения задач.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 722; Нарушение авторских прав?; Мы поможем в написании вашей работы!