
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 8
|
|
|
|
Бромбензол от высококипящих примесей очищают перегонкой с водяным паром. Рассчитать расходный коэффициент водяного пара, если при температуре перегонки равной 94°С, давление паров воды рано 620 мм.рт.ст., а давление бромбензола 110 мм.рт.ст.
| Х -? | Cu | В данной задаче используется формула расходного коэффициента
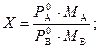
|
| tп = 94°С Pв° = 620 мм.рт.ст. Рб = 110 мм.рт.ст. | 367 К 82659,87 Па 14665,46 Па |
МВ = 18×10-3 кг/моль
М(С6Н5Br) = 157×10-3 кг/моль
Х = 82659,87×18×10-3/(14665,46×157×10-3) = 0,65
То есть на 1 кг бромбензола берётся 0,65 кг воды для очистки от высококипящих жидкостей.
Пример 9
Определить какое максимальное количество I2 можно извлечь из 10 м3 минеральной воды, если концентрация йода в ней равна 3 × 10-3 моль/л, экстрагент хлороформ, объёмом 0,1 м3. Коэффициент распределения равен 0,0075. При одноступенчатой и четырёхступенчатой экстракции.
| CИ 3 моль/м3 | Данная задача на процесс экстракции, расчёты проводят по формуле:
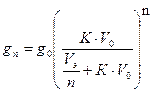
|
Решение:
1) Находим g0 – масса экстрагируемого вещества (I2) в исходном растворе.
g0 = n×M; С = n/V0; n = С×V0; g 0 = С V 0 M
g0 = 3 × 10 × 254 ×10-3 = 7,62 кг
2) Находим g1 – масса I2 в рафинате g 1 = 7,62×0,0075×10/(0,1 + 0,0075×10) = 3,26 кг
3) Находим g0 – g 1 – массу I2, которое можно извлечь при 1-ступенчатой экстракции
g0 – g1 = 7,62 – 3,26 = 4,36 (кг)
При 4-х ступенчатой экстракции в каждой ступени используется объём экстрагента = VЭ = 0,025м3
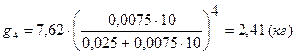
g0 – g4 = 7,62 – 2,41 = 5,21 (кг), то есть при 4-х ступенчатой экстракции извлекают большее количество I2, чем при 1-ступенчатой.
Пример 10
Коэффициент распределения янтарной кислоты между водой и эфиром равен 6. Концентрация янтарной кислоты в воде равна 48 моль/м3. Определить концентрацию янтарной кислоты в эфире.
| СЭФ -? | Используем закон распределения Нернста К = С1/С2 Для данной задачи К = СВ /СЭФ; СЭФ = СВ/К С ЭФ = 48/6 = 8 моль/м3 |
| К = 6 СВ = 48 моль/м3 |
Пример 11
Коэффициент растворимости ацетилена в воде при 30°С равен 0,93. Вычислить коэффициент абсорбции.
| a -? | S/a = T/T0 a = S×T0/T a = 0,93×273/303 = 0,84. |
| S = 0,93 T = 303 K T0 = 273 K |
Вопросы для самоконтроля
1.Назовите причины понижения давления пара растворителя над раствором с нелетучим компонентом.
2.На чём основано действие антифризов?
3.Проанализируйте диаграммы состояния 2-х компонентной системы для идеальной смеси (Р – состав), (Т кипения – состав).
4.Назовите условия проведения ректификации.
5.Системы с отклонениями от закона Рауля. Проанализируйте диаграммы состояния 2-х компонентных реальных смесей (Р – состав; Т кипения – состав). Азеотропная смесь.
6.Особенности перегонки.
7.Почему при повышении температуры растворимость газов уменьшается?
Тема 1.8. Электрохимия.
Этот раздел физической химии изучает закономерности и взаимные превращения между электрической и химической энергии.
Вещества, которые проводят электрический ток называются проводниками.
Проводники I рода – металлы и их сплавы.
Проводники II рода – растворы и расплавы электролитов.
При погружении металла (электрод) в полярный растворитель на границе раздела фаз возникает скачок потенциала j (фи), за счёт образования двойного электрического слоя, он в свою очередь образуется за счёт взаимодействия электрода с раствором, при этом происходит переход катионов металла с электрода в раствор или наоборот, то есть
скачок потенциала, который возникает на границе электрод-раствор при условии равновесия между электродом и раствором называется равновесным электродным потенциалом.
Он рассчитывается по формуле Нернста:
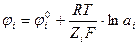 – формула для концентрированных растворов.
– формула для концентрированных растворов.
ji° - нормальный электродный потенциал;
F – число Фарадея (1F = 96500 Кл/моль);
Z i – степень окисления – восстановления ионов;
ai – активность ионов i в растворе.
ji° - потенциал данного металла, погружённого в раствор при t = 25°С с активностью ai = 1.
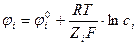 – формула для разбавленных растворов.
– формула для разбавленных растворов.
Если металлы расположить в порядке возрастания их нормальных электродных потенциалов, то получим электрохимический ряд напряжения металлов или ряд химической активности:
Li, K, Ca, Na, Mg, Al, Mn, Zn, Fe, Ni, H2, Cu, Ag, Au.
j° каждого металла дано в справочной литературе.
j°(Н2) = 0.
У металлов до Н2 j° < 0, после Н2 j° > 0.
Устройство, в котором химическая энергия (то есть энергия химических реакций) превращается в электрическую называется гальваническим элементом.
В них непрерывно протекают окислительно-восстановительные процессы. На электродах поддерживается разность потенциалов, которая определяет ЭДС – электродвижущую силу элемента:
ЭДС = j2 – j1
j2 – потенциал положительного электрода (анода)
j1 – потенциал отрицательного электрода (катода).
ЭДС является мерой способности гальванического элемента совершать электрическую работу.
Электролизом называют совокупность окислительно-восстановительных процессов, протекающих у катода и анода при прохождении постоянного электрического тока через растворы или расплавы электролитов.
Протекание первичных анодных и катодных процессов подчиняются законам Фарадея.
1 закон Фарадея.
Масса вещества (m), выделяемая на электроде прямо пропорциональна количеству электричества (Q), прошедшего через электролит.
m = КּQ Q = KּIּt
[Q] = 1Кл (Кулон)
I – сила тока, А (Ампер)
t - время, с
К – электрохимический эквивалент.
Еw= 1,0183В.
2 Закон Фарадея
Количество различных веществ, прореагировавших при электролизе на электродах под действием одинакового количества электричества, пропорциональны их химическим эквивалентам.
m1/m2 = Э1/Э2
Для выделения 1 эквивалента вещества требуется пропустить через электролит одно и то же количество электричества – число Фарадея.
F = 96500 Кл/моль
Объединённое выражение 1,2 закона Фарадея: m = Э×It/F
Результаты расчётов и опыта отличаются, поэтому вводят поправочный коэффициент – выход по току h.
h = m пр ×100% /m теор; h = Q теор × 100% / Qпр.
M пр, m теор – масса фактически выделенного вещества и масса, рассчитанная по закону Фарадея.
Q пр – количество электричества, практически затраченного на выделение данного количества вещества.
Q теор – количество электричества, необходимое по закону Фарадея.
То есть закон Фарадея можно представить в виде формулы: m пр = h×Э×I×t/F
Примеры решения задач.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 1581; Нарушение авторских прав?; Мы поможем в написании вашей работы!