
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния. Уравнением состояния называется уравнение, устанавливающее взаимосвязь между термическими параметрами
|
|
|
|
Уравнением состояния называется уравнение, устанавливающее взаимосвязь между термическими параметрами, т.е. ¦(P,V,T) = 0. Вид данной функции зависит от природы рабочего тела. Различают идеальные и реальные газы.
Идеальным называется газ, для которого можно пренебречь собственным объемом молекул и силами взаимодействия между ними. Простейшим уравнением состояния идеального газа является уравнение Менделеева – Клапейрона 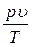 = R = const, где R – константа, зависящая от химической природы газа, и которая называется характеристической газовой постоянной. Из данного уравнения следует:
= R = const, где R – константа, зависящая от химической природы газа, и которая называется характеристической газовой постоянной. Из данного уравнения следует:
Pu = RT (1 кг)
PV = mRT (m кг)
Простейшим уравнением состояния реального газа является уравнение Ван- дер-Ваальса
(P + 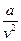 ) × (u - b) = RT
) × (u - b) = RT
где 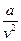 - внутреннее давление
- внутреннее давление
где a, b – постоянные, зависящие от природы вещества.
В предельном случае (для идеального газа)
 u ® ¥ a ® 0
u ® ¥ a ® 0
u2
u >> b Pu = RT
Для определения характеристической газовой постоянной R запишем уравнение Менделеева-Клапейрона (далее М.-К.) для P0 = 760 мм.рт.ст., t0=0, 0C
P0u0 = RT0
умножим обе части уравнения на величину m, которая равна массе киломоля газа mP0u0 = mRT0 mu0 = Vm = 22,4 [м3/кмоль]
mR = Rm = P0Vm/ T0 = 101,325*22,4/273,15 = 8314 Дж/кмоль×К
Rm - не зависит от природы газа и поэтому называется универсальной газовой постоянной. Тогда характеристическая постоянная равна:
R= Rm/m=8314/m; [Дж/кг×К].
Выясним смысл характеристической газовой постоянной. Для этого запишем уравнение М.-К. для двух состояний идеального газа, участвующего в изобарном процессе:
P1V1=mRT1
P2V2=mRT2
P(V2-V1)=mR(T2-T1)
P(V2-V1) L

 R= =; где L – работа изобарного процесса.
R= =; где L – работа изобарного процесса.
m(T2-T1) m(T2-T1)
Таким образом, характеристическая газовая постоянная представляет собой механическую работу (работу изменения объема), которую совершает 1 кг газа в изобарном процессе при изменении его температуры на 1 К.
Лекция №2
Калорические параметры состояния
Внутренняя энергия вещества представляет собой сумму кинетической энергии теплового движения атомов и молекул потенциальной энергии взаимодействия, энергии химических связей, внутриядерной энергии и т.д.
U = UКИН + UПОТ + UХИМ + UЯД. +…
В т.д процессах изменяются только первые 2 величины, остальные не изменяются, так как не в этих процессах не изменяется химическая природа вещества и строение атома.
В расчетах определяется не абсолютное значение внутренней энергии, а ее изменение и поэтому в термодинамике принято, что внутренняя энергия состоит только из 1-го и 2-го слагаемых, т.к. в расчетах остальные сокращаются:
∆U = U2+U1 = UКИН+ UПОТ … Для идеального газа UПОТ = 0. В общем случае
UКИН = f(T); UПОТ = f(p, V)
U = f(p, T); UПОТ = f(p, V); U = f(V,T)
Для идеального газа можно записать следующее соотношение:
U = f(T);
Т.е. внутренняя энергия зависит толлько от
теммпературы и не зависит от давления и объема
u = U/m; [Дж/кг]-удельная внутренняя энергия
Рассмотрим изменение внутренней энергии рабочего тела, совершающего круговой процесс или цикл
 p
p
 1
1
m
n
 u
u
∆u1m2 = u2 - u1 ; ∆U1n2 = u1 – u2; ∆u∑ = ∆u1m2 – ∆u2n1 = 0 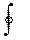 du = 0
du = 0
Из высшей математики известно, что если данный нтеграл равен нулю, то величина du представляет собой полный дифференциал функции
u = u(T, u) и равен
du = (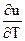 )udT + (
)udT + (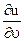 )Tdu
)Tdu
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 640; Нарушение авторских прав?; Мы поможем в написании вашей работы!