
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение количества теплоты
|
|
|
|
Определение величины работы изменения объема в т.д. процессах.
Рассмотрим работу, совершаемую т.д. системой, при изменении ее объема.
| |||
 | |||

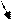


|

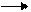
 |  | ||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
Величина интеграла зависит от вида т.д. процесса. Знак величины работы однозначно зависит от величины изменения объема: du > 0, dl > 0 при расширении газа работа положительна;
du < 0, dl < 0
В общем случае общая работа определяется как Lобщ = l + ∑l*
Графически величина работы изменения объема определяется, как площадь под графиком процесса.
| |||||
 | |||||
 | |||||
 1
1

 2
2
 | |||
| |||
Кол-во теплоты учавствующее в т.д. может быть определено двумя способами:
1. Способ с использованием энтропии ds = dq/T; dq = Tds; q = 
2. С использованием теплоемкости
Удельной теплоемкостью называется количество теплоты, которое необходимо подвести или отвести от единицы вещества (1кг, 1 м3, 1моль) для изменения температуры на 1К.
 где х – параметр, определяющий вид т.д. процесса.
где х – параметр, определяющий вид т.д. процесса.
m– medium (средний).
Схм =  - средняя теплоемкость в интервале температур t1,t2
- средняя теплоемкость в интервале температур t1,t2
qx
|

 t 1 t2
t 1 t2
В зависимости от выбора единицы количества вещества различают массовую, мольную, объемную теплоемкости.
С – [Дж/кгК] – массовая;
С’ – [Дж/м3К] – объемная;
μС – [Дж/кмольК] – мольная;
В зависимости от вида т.д. процесса различают теплоемкость при постоянном давлении Ср и при постоянном объеме СV.
Для идеального газа соотношение между Ср и Сv устанавливаются уравнением Майера: Ср - Сv = R
Для реальных газов Ср - Сv > R, и уравнением Майера не выполняется.
В т.д. расчетах используют соотношение величин  = К, где К – показатель адиабаты (коэффициент Пуассона)..Для идеального газа величина К не зависит от химической природы вещества, а определяется только его атомностью газа, т.е. количества атомов в молекуле (для одноатомных газов К = 1.67, для двухатомных – К =1.4, для трехатомных и многоатомных - К = 1.3)
= К, где К – показатель адиабаты (коэффициент Пуассона)..Для идеального газа величина К не зависит от химической природы вещества, а определяется только его атомностью газа, т.е. количества атомов в молекуле (для одноатомных газов К = 1.67, для двухатомных – К =1.4, для трехатомных и многоатомных - К = 1.3)
Решая два уравнения совместно:
Ср - Сv = R и  = К,
= К,
получаем:
Сv =  Ср =
Ср = 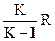
Для реальных газов теплоемкость зависит от температуры. Эта зависимость может быть представлена таким образом:
Сх = Сх0 + ∆Сх, где
Сх0 – теплоемкость газа в идеальном газовом состоянии;
∆Сх – поправка, учитывающая реальность газов.
По экспериментальным данным зависимость теплоемкости от температуры представляется в виде полинома:
Сх = а + bt + рt2 + dt3 + …
Отсюда следует, что количество тепла может быть определено по уравнениям:
qx = 
qx = Cxm (t2 – t1)
Расчетная формула (2) может быть упрощена следующим образом
 =
= 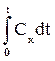 -
- 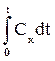 ;
;
qx = Cxm t2 – Cxm t1
ЛЕКЦИЯ №3
Первый закон термодинамики
Первый закон термодинамики представляет собой частный случай всеобщего превращения энергии. Энергия не появляется и не исчезает, а переходит из одного вида в другой в эквивалентных количествах.
Рассмотрим запас энергии произвольной т.д. системы:
E = U + Eпот+ Eкин
Если система неподвижна, то Eкин=0, а зачастую можно пренебречь значением потенциальной энергии Eпот ≈ 0 (за исключением отдельных случаев), то
E = U
Если т.д. система не взаимодействует с окружающей средой (о.с.), то уравнение первого закона термодинамики записывается следующим образом:
ΔE =0, E2 – E1 = 0, U2 – U1 = 0, => U=const








 Если т.д. система взаимодействует с о.с., то общий запас ее энергии, при переходе из одного состояния в другое, изменяется на величину энергетического взаимодействия с о.с.: Q
Если т.д. система взаимодействует с о.с., то общий запас ее энергии, при переходе из одного состояния в другое, изменяется на величину энергетического взаимодействия с о.с.: Q
 E2 = E1 + ∑ΔEі ;
E2 = E1 + ∑ΔEі ;
U2 = U1 + ∑ΔEі ; L
∑ΔEі = Q – L; => U2 = U1 + Q – L;
Q = (U2 – U1) + L; dQ = dU + dL; =>
dq = du + dl = du + pdυ
Первый закон т.д.
Если т.д. система совершает работу связанную с изменением объема, то:
dl = pdυ + dl*
h = U + pυ; dh = du + pdυ + υdp => dh = dq + υdp, тогда
dq = dh – υdp
· 
 Рассмотрим первый закон т.д. для тела совершающего круговой процесс или цикл: P
Рассмотрим первый закон т.д. для тела совершающего круговой процесс или цикл: P



 =
= 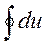 +
+ 
 =
= 
V
В соответствии с уравнением, тепловая машина не может совершать работы больше, чем подведенное тепло: ηц ≤ 1, следовательно,
невозможно построить вечный двигатель первого рода, т.е. тепловую машину, совершающую работу без затрат энергии извне.
Первый закон т.д. позволяет сделать еще один очень важный вывод.
Рассмотрим первый закон т.д. для изохорного и изобарного процесса:
u = const du = 0; => dqu = du; CvdT = dU => Cv = (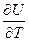 )u
)u
p = const dp = 0; => dqp = dh; dqp = CpdT => CpdT = (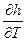 )p.
)p.
Основные т.д. процессы идеального газа
Т.д. процессом наз. любое изменение в т.д. системе сопровождающееся изменением т.д. параметров состояния. Основными т.д. процессами являются:
Изохорный, изобарный, изотермический, адиабатный, политропный.
Изохорный
1. u = const.
2. p1u1 = RT1  =
= 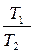
p1u1 = RT1
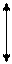
 3. p
3. p
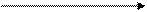 v
v
3. Du = Cv(T2 – T1) 
5. Dh = CP(T2 – T1)
6. dl = pdu; du = 0; => l =0;
7. dq = du + pdu qu = Du;
8. dsu =  =
= 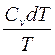
Dsu = s2 – s1 = 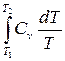 = Cvln
= Cvln 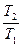
ИЗОБАРНЫЙ
1. p = const.
2. p1u1 = RT1  =
= 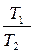
p1u1 = RT1
3.  p
p







 1 2
1 2
 |
u
4. Du = Cv(T2 – T1) 
5. Dh = CP(T2 – T1)
6. dl = pdu; l =  = p(u2 - u1);
= p(u2 - u1);
7. dq = dh – υdp => qp = Dh
6. dsp =  =
= 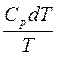

 Dsp = s2 – s1 =
Dsp = s2 – s1 = 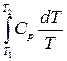 = Cpln
= Cpln 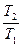 T u=const
T u=const
p=const
 s
s
ИЗОТЕРМИЧЕСКИЙ
1. Т = const.
2. p1u1 = RT1 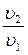 =
= 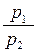
3. p 
 | |||
 |
v
4. Du = 0;
5. Dh = 0; т.к. T = 0;
6. dl = pdu; l = 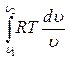 = RTln
= RTln 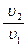 = RT
= RT 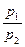
7. dq = du + dl; q = l = RTln 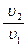 = RT
= RT 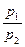 ;
;
8. Ds = s2 – s1 =  =
= 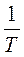 q = RTln
q = RTln 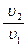 = Rln
= Rln 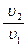 ;
;
9. 

 T
T








 q q = T(s2 – s1)
q q = T(s2 – s1)
s
АДИАБАТНЫЙ
1. Адиабатный процесс – процесс, протекающий без теплообмена с окружающей средой.
q = 0; dq = du + dl = CvdT + pdu = 0; dq = dh - udp = CpdT - udp = 0;
CvdT = - pdu; CpdT = udp
 = -
= - 
 = K => Kpdu + udp = 0; разделим переменные на
= K => Kpdu + udp = 0; разделим переменные на 

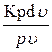 +
+ 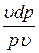 = 0;
= 0;  +
+ 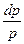 = 0; => Klnu + lnp = lnC; => lnuk + lnp = lnC;
= 0; => Klnu + lnp = lnC; => lnuk + lnp = lnC;
ln(puk) = lnC; => puk = lnC; puk = const
p1u1k = p2u2k; 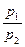 = (
= (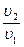 )k p1 =
)k p1 = 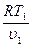 ; p2 =
; p2 = 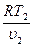 ;
;
 2.
2. 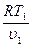 *
*  = (
= (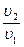 )k
)k 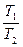 = (
= (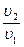 )k – 1
)k – 1 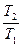 = (
= (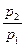 )(k –1)/k
)(k –1)/k
3.график в p-v координатах
p 


 puk = const
puk = const
T = const


v
4. Du = Cv(T2 – T1)
5. Dh = CP(T2 – T1)
6. dq = du + dl, т.к. dq = 0, то dl = - du => L = - DU – в адиабатном процессе работа совершается за счет убыли полной внутренней энергии.
l = - Cv(T2 – T1) = Cv(T1 – T2);
7. q = 0
8. ds =  = 0; s2 – s1 = const; адиабатный процесс – изоэнтропный.
= 0; s2 – s1 = const; адиабатный процесс – изоэнтропный.

T 
 s
s
Лекция №4
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 751; Нарушение авторских прав?; Мы поможем в написании вашей работы!

 =
= 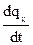 Cx – истинная теплоемкость
Cx – истинная теплоемкость