
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Парасимпатическая нервная система 1 страница
|
|
|
|
Ацетилхолин. Ацетилхолин служит нейромедиатором во всех вегетативных ганглиях, в постганглионарных парасимпатических нервных окончаниях и в постганглионарных симпатических нервных окончаниях, иннервирующих экзокринные потовые железы. Фермент холинацетилтрансфераза катализирует синтез ацетилхолина из ацетил КоА, продуцируемого в нервных окончаниях, и из холина, активно поглощаемого из внеклеточной жидкости. Внутри холинергических нервных окончаний запасы ацетилхолина сохраняются в дискретных синаптических пузырьках и высвобождаются в ответ на нервные импульсы, деполяризующие окончания нервов и увеличивающие поступление кальция внутрь клетки.
Холинергические рецепторы. Различные рецепторы для ацетилхолина существуют на постганглионарных нейронах в вегетативных ганглиях и в постсинаптических вегетативных эффекторах. Рецепторы, расположенные в вегетативных ганглиях и в мозговом веществе надпочечников, стимулируются главным образом никотином (никотиновые рецепторы), а те рецепторы, которые находятся в вегетативных клетках эффекторных органов, стимулируются алкалоидом мускарином (мускариновые рецепторы). Ганглиоблокирующие средства действуют против никотиновых рецепторов, в то время как атропин блокирует мускариновые рецепторы. Мускариновые (М) рецепторы подразделяются на два типа. Mi-рецепторы локализуются в центральной нервной системе и, возможно, в парасимпатических ганглиях; М2-рецепторы представляют собой ненейронные мускариновые рецепторы, расположенные на гладкой мускулатуре, миокарде и эпителии желез. Селективным агонистом М2-рецепторов служит bнехол; проходящий испытания пирензепин (Pirenzepine) представляет собой селективный антагонист M1-рецепторов. Этот препарат вызывает значительное снижение секреции желудочного сока. Другими медиаторами мускариновых эффектов могут служить фосфатидилинозитол и угнетение активности аденилатциклазы.
Ацетилхолинэстераза. Гидролиз ацетилхолина ацетилхолинэстеразой инактивирует этот нейромедиатор в холинсргических синапсах. Этот фермент (известный также под названием специфической, или истинной, холинэстеразы) присутствует в нейронах и отличается от бутирохолинэстеразы (холинэстеразы сыворотки крови или псевдохолинэстеразы). Последний фермент присутствует в плазме крови и в ненейронных тканях и не играет первостепенной роли в прекращении действия ацетилхилина в вегетативных эффекторах. Фармакологические эффекты антихолинэстеразных средств обусловлены угнетением нейронной (истинной) ацетилхолинэстеразы.
Физиология парасимпатической нервной системы. Парасимпатическая нерв ная система участвует в регуляции функций сердечно-сосудистой системы, пищеварительного тракта и мочеполовой системы. Ткани таких органов, как печень, ночки, поджелудочная и щитовидная железы, также обладают парасимпатической иннервацией, что позволяет предположить участие парасимпатической нервной системы также и в регуляции обмена веществ, хотя холинергическое воздействие на обмен веществ охарактеризовано недостаточно ясно.
Сердечно-сосудистая система. Парасимпатическое воздействие на сердце опосредуется через блуждающий нерв. Ацетилхолин уменьшает скорость спонтанной деполяризации синусно-предсердного узла и снижает частоту сердечных сокращений. Частота сердечных сокращений при различных физиологических состояниях является результатом координированного взаимодействия между симпатической стимуляцией, парасимпатическим угнетением и автоматической активностью синусо-предсердного водителя ритма. Ацетилхолин также задерживает проведение возбуждения в мышцах предсердия при укорачивании эффективного рефрактерного периода; такое сочетание факторов может вызвать развитие или постоянное сохранение предсердных аритмий. В предсердно-желудочковом узле он снижает скорость проведения возбуждения, увеличивает продолжительность эффективного рефрактерного периода и тем самым ослабляет реакцию желудочков сердца во время трепетания предсердий или их фибрилляции (гл. 184). Вызываемое ацетилхолином ослабление инотропного действия связано с пресинаптцческим угнетением симпатических нервных окончаний, а также с прямым угнетающим действием на миокард предсердий. Миокард желудочков испытывает меньшее влияние ацетилхолина, поскольку его иннервация холинергическими волокнами минимальна. Прямое холинергическое воздействие на регуляцию периферической резистентности кажется маловероятным из-за слабой парасимпатической иннервации периферических сосудов. Однако парасимпатическая нервная система может влиять на периферическую резистентность опосредованно путем угнетения высвобождения норадреналина из симпатических нервов.
Пищеварительный тракт. Парасимпатическая иннервация кишечники осуществляется через блуждающий нерв и тазовые крестцовые нервы. Парасимпатическая нервная система повышает тонус гладкой мускулатуры пищеварительного тракта, расслабляет сфинктеры, усиливает перистальтику. Ацетилхолин стимулирует экзогенную секрецию эпителием желез гастрина, секретина и инсулина.
Мочеполовая и дыхательная системы. Крестцовые парасимпатические нервы иннервируют мочевой пузырь и половые органы. Ацетилхолин усиливает перистальтику мочеточников, вызывает сокращение мускулатуры мочевого пузыря, осуществляющей его опорожнение, и расслабляет мочеполовую диафрагму и сфинктер мочевого пузыря, тем самым играя основную роль в координации процесса мочеиспускания. Дыхательные пути иннервированы парасимпатическими волокнами, отходящими от блуждающего нерва. Ацетилхолин увеличивает секрецию в трахее и бронхах и стимулирует бронхоспазм.
Фармакология парасимпатической нервной системы. Холинергические агонисты. Терапевтическое значение ацетилхолина невелико из-за большой разбросанности его влияний и непродолжительности действия. Однородные с ним вещества менее чувствительны к гидролизу холинэстеразой и имеют более узкий диапазон физиологических эффектов. bнехол, единственный системный холинергический агонист, применяемый в повседневной практике, стимулирует гладкую мускулатуру пищеварительного тракта и мочеполовых путей. оказывая минимальное влияние на сердечно-сосудистую систему. Его используют при.печении задержки мочи в случае отсутствия обструкции мочевыводящих путей и реже при лечении нарушений функции пищеварительного тракта, таких как атония желудка после ваготомии. Пилокарпин и карбахол являются холинергическими агонистами местного действия, используемыми для лечения глаукомы.
Ингибиторы ацетилхолинэстеразы. Ингибиторы холинэстеразы усиливают воздействие парасимпатической стимуляции путем снижения инактивации ацетилхолина. Терапевтическое значение обратимых ингибиторов холинэстеразы зависит от роли ацетилхолина как нейромедиатора в синапсах скелетных мышц между нейронами и клетками-эффекторами и в центральной нервной системе и включает в себя лечение миастении (гл. 358), прекращение нервно-мышечной блокады, развившейся после наркоза, и аннулирование интоксикации, вызванной веществами, обладающими центральной антихолинергической активностью. Физостигмин, представляющий собой третичный амин, легко проникает в центральную нервную систему, в то время как родственные ему четвертичные амины [прозерин, пиридостигмина бромид, оксазил и эдрофоний (Edrophonium)] этим свойством не обладают. Фосфорорганические ингибиторы холинэстеразы вызывают необрати-мую блокаду холинэстеразы; эти вещества используют главным образом в качестве инсектицидов, и они представляют в основном токсикологический интерес. Что касается вегетативной нервной системы, ингибиторы холинэстеразы находят ограниченное применение для лечения дисфункции гладкой мускулатуры кишечника и мочевого пузыря (например, при паралитической непроходимости кишечника и атонии мочевого пузыря). Ингибиторы холинэстеразы вызывают ваготоническую реакцию в сердце и могут быть эффективно использованы с целью прекращения приступов пароксизмальной суправентрикулярной тахикардии (гл. 184).
Вещества, блокирующие холинергические рецепторы. Атропин блокирует мускариновые холинергические рецепторы и незначительно влияет на холинергическую нейропередачу в вегетативных ганглиях и нервно-мышечных синапсах. Многие воздействия атропина и атропиноподобных лекарственных средств на центральную нервную систему могут быть отнесены на счет блокады центральных мускариновых синапсов. Однородный алкалоид скополамин сходен по своему действию с атропином, но вызывает сонливость, эйфорию и амнезию — эффекты, которые позволяют использовать его для проведения премедикации перед обезболиванием.
Атропин увеличивает частоту сердечных сокращений и повышает атриовентрикулярную проводимость; это делает целесообразным его применение при лечении брадикардии или сердечной блокады, связанной с повышенным тонусом блуждающего нерва. Кроме того, атропин снимает опосредуемый через холинергические рецепторы бронхоспазм и уменьшает секрецию в дыхательных путях, что позволяет применять его для премедикации перед наркозом.
Атропин также снижает перистальтику пищеварительного тракта и секрецию в нем. Хотя различные производные атропина и родственные ему вещества [например, пропантелин (Propantheline), изопропамид (Isopropamide) и гликопирролат (Glycopyrrolate) ] пропагандировали в качестве средств для лечения больных, страдающих язвой желудка или диарейным синдромом, длительное применение этих лекарственных препаратов ограничивается такими проявлениями парасимпатического угнетения, как сухость во рту и задержка мочи. Пирензепин, проходящий испытание селективный Mi-ингибитор, угнетает секрецию в желудке, используемый в дозах, оказывающих минимальное антихолинергическое действие в других органах и тканях; этот препарат может быть эффективен при лечении язвы желудка. При ингаляции атропин и родственное ему вещество ипратропий (Ipratropium) вызывают расширение бронхов; они были использованы в экспериментах для лечения бронхиальной астмы.
ГЛАВА 67. АДЕНИЛАТЦИКЛАЗНАЯ СИСТЕМА
Генри Р. Боурн (Henry R. Bourne)
Циклический 3`5`-монофосфат (циклический АМФ) действует в качестве внутриклеточного вторичного медиатора для множества разнообразных пептидных гормонов и биогенных аминов, лекарственных средств и токсинов. Следовательно, изучение аденилатциклазной системы необходимо для понимания патофизиологии и лечения многих болезней. Исследование роли вторичного медиатора циклического АМФ расширило наши знания об эндокринной, нервной и сердечнососудистой регуляции. И наоборот, исследования, ставившие своей целью разгадать биохимические основы определенных заболеваний, способствовали пониманию молекулярных механизмов, регулирующих синтез циклического АМФ.
Биохимия. Последовательность действия ферментов, участвующих в реализации эффектов гормонов (первичных медиаторов) осуществляющихся через циклический АМФ, представлена на рис. 67-1, а перечень гормонов, действующих с помощью этого механизма, приведен в табл. 67-1. Деятельность этих гормонов инициируется их связыванием со специфическими рецепторами, расположенными на наружной поверхности плазматической мембраны. Комплекс гормон — рецептор активирует связанный с мембраной фермент аденилатциклазу, которая синтезирует циклический АМФ из внутриклеточного АТФ. Внутри клетки циклический АМФ передает информацию от гормона, связываясь с собственным рецептором и активируя этот рецептор-зависимую от циклического АМФ протеинкиназу. Активированная протеинкиназа передает концевой фосфор АТФ специфическим белковым субстратам (как правило, ферментам). Фосфорилирование этих ферментов усиливает (или в некоторых случаях угнетает) их каталитическую активность. Измененная активность этих ферментов и вызывает характерное действие определенного гормона на его клетку-мишень.
Второй класс гормонов действует путем связывания с мембранными рецепторами, которые ингибируют аденилатциклазу. Действие этих гормонов, обозначаемых Ни, в отличие от стимулирующих гормонов (Не) описано ниже более детально. На рис. 67-1 показаны также дополнительные биохимические механизмы, ограничивающие действие циклического АМФ. Эти механизмы также могут регулироваться при участии гормонов. Это позволяет осуществлять тонкую настройку функции клеток с помощью дополнительных нервных и эндокринных механизмов.
Биологическая роль циклического АМФ. Каждая из белковых молекул, участвующих в сложных механизмах стимулирования — угнетения, представленных на рис. 67-1, представляет собой потенциальное место регуляции гормональной реакции на терапевтическое и токсическое действие лекарственных средств и на патологические изменения,, возникающие в ходе заболевания. Специфические примеры таких взаимодействий обсуждаются в последующих разделах этой главы. Для сведения их воедино следует рассмотреть общие биологические функции АМФ в качестве вторичного медиатора, что целесообразно сделать на примере регуляции процесса высвобождения глюкозы из запасов гликогена, содержащихся в печени (биохимическая система, в которой был обнаружен циклический АМФ), с помощью глюкагона и других гормонов.
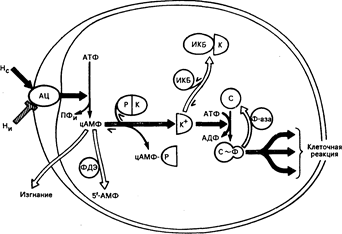
Рис. 67-1. Циклический АМФ — вторичный внутриклеточный медиатор для гормонов.
На рисунке изображена идеальная клетка, содержащая молекулы белка (ферменты), участвующие в медиаторных действиях гормонов, осуществляемых через циклический АМФ. Черные стрелки указывают путь потока информации от стимулирующего гормона (Не) до клеточной реакции, в то время как светлые стрелки указывают направление противоположных процессов, модулирующих или ингибирующих поток информации. Внеклеточные гормоны стимулируют (Не) или ингибируют (Ни) мембранный фермент — аденилатциклазу (АЦ) (см. описание в тексте и рис. 67-2). АЦ превращает АТФ в циклический АМФ (цАМФ) и пирофосфат (ПФи). Внутриклеточная концентрация циклического АМФ зависит от соотношения между скоростью его синтеза и характеристиками двух других процессов, направленных на выведение его из клетки: расщепление циклической нуклеотидной фосфодиэстеразой (ФДЭ), которая превращает циклический АМФ в 5'-АМФ, и удаление из клетки энергетически-зависимой транспортной системой. Внутриклеточные эффекты циклического АМФ опосредуются или регулируются белками по меньшей мере пяти дополнительных классов. Первый из них — зависимая от цАМФ протеинкиназа (ПК) — состоит из регулирующих (Р) и каталитических (К) субъединиц. В голоэнзиме ПК субъединица К каталитически неактивна (ингибирована субъединицей Р). Циклический АМФ действует, связываясь с субъединицами Р, высвобождая субъединицы К из комплекса цАМФ-Р. Свободные каталитические субъединицы (К+) катализируют передачу концевого фосфора АТФ в специфические белковые субстраты (С), например, фосфорилазкиназу. В фосфорилированном состоянии (С~Ф) эти белковые субстраты (обычно ферменты) инициируют характерные эффекты циклического АМФ внутри клетки (например, активацию гликогенфосфорилазы, ингибирование гликогенсинтетазы). Доля белковых субстратов киназы в фосфорилированном состоянии (С~Ф) регулируется белками двух дополнительных классов: ингибирующий киназу белок (ИКБ) обратимо связывается с К^, делая ее каталитически неактивной (ИКБ—К) Фосфатазы (Ф-аза) превращают С~Ф обратно в С, отнимая ковалентно связанный фосфор.
Перенос гормональных сигналов через плазматическую мембрану. Биологическая стабильность и структурная сложность пептидных гормонов, подобных глюкагону, делают их носителями разнообразных гормональных сигналов между клетками, но ослабляют их способность проникать через клеточные мембраны. Гормончувствительная аденилатциклаза позволяет информационному содержанию гормонального сигнала проникать через мембрану, хотя сам гормон не может проникнуть через нее.
Таблица 67-1. Гормоны, для которых циклический АМФ служит в качестве вторичного медиатора
| Гормон | Мишень:орган/ткань | Типичное действие |
| Адренокортикотропный гормон | Кора надпочечников | Продуцирование корти-зола |
| Кальцитонин | Кости | Концентрация кальция в сыворотке крови |
| Катехоламины (b-адре-нергические) | Сердце | Частота сердечных сокращений, сократимость миокарда |
| Хорионический гонадо-тропин | Яичники, семенники | Продуцирование половых гормонов |
| Фолликулостимулирую-щий гормон | Яичники, семенники | Гаметогенез |
| Глюкагон | Печень | Гликогенолиз, высвобождение глюкозы |
| Лютеинизирующий гормон | Яичники, семенники | \ Продуцирование половых гормонов |
| Рилизинг-фактор лютеи-низирующего гормона | Гипофиз | f Высвобождение лютеи-низирующего гормона |
| Меланоцитстимулирую-щий гормон | Кожа (меланоциты) | T Пигментация |
| Гормон паращитовидных желез | Кости, почки | T Концентрация кальция в сыворотке крови [ концентрация фосфора в сыворотке крови |
| Простациклин, проста-гландин е| | Тромбоциты | [ Агрегация тромбоцитов |
| Тиреотропный гормон | Щитовидная железа | T Продуцирование и высвобождение Тз и Т4 |
| Рилизинг-фактор тирео-тропного гормона | Гипофиз | f Высвобождение тирео-тропного гормона |
| Вазопрессин | Почки | f Концентрация мочи |
Примечание. Здесь перечислены только наиболее убедительно подтвержденные эффекты, опосредуемые циклическим АМФ, хотя многие из этих гормонов проявляют многочисленные действия в различных органах-мишенях.
Усиление. Связываясь с небольшим числом специфических рецепторов (вероятно, меньшим, чем 1000 на клетку), глюкагон стимулирует синтез гораздо большего числа молекул циклического АМФ. Эти молекулы в свою очередь стимулируют зависимую от циклического АМФ протеинкиназу, которая вызывает активацию тысяч молекул содержащейся в печени фосфорилазы (фермента, ограничивающего распад гликогена) и последующее высвобождение миллионов молекул глюкозы из единичной клетки.
Метаболическая координация на уровне единичной клетки. Помимо того что обусловленное циклическим АМФ фосфорилирование белка стимулирует фосфорилазу и способствует превращению гликогена в глюкозу, этот процесс одновременно дезактивирует фермент, синтезирующий гликоген (гликогенсинтетазу), и стимулирует ферменты, вызывающие глюконеогенез в печени. Таким образом, единичный химический сигнал — глюкагон — мобилизует энергетические резервы посредством нескольких путей метаболизма.
Преобразование разнообразных сигналов в единую метаболическую программу. Поскольку содержащаяся в печени аденилатциклаза может стимулироваться адреналином (действующим через b-адренорецепторы) так же, как и глюкагоном, циклический АМФ позволяет двум гормонам, обладающим различным химическим строением, регулировать углеводный обмен в печени. Если бы не существовало вторичного медиатора, то каждый из регулирующих ферментов, участвующих в мобилизации углеводов печени, должен был бы обладать способностью распознавать как глюкагон, так и адреналин.
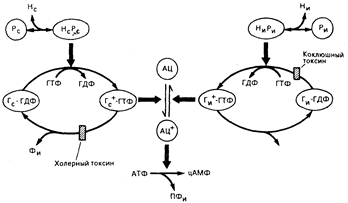
Рис. 67-2. Молекулярный механизм регуляции синтеза циклического АМФ гормонами, гормональными рецепторами и Г-белками. Аденилатциклаза (АЦ) в ее активной форме (АЦ+) превращает АТФ в циклический АМФ (цАМФ) и пирофосфат (ПФи). Активация и ингибирование АЦ опосредуются формально идентичными системами, показанными в левой и правой частях рисунка. В каждой из этих систем Г-белок колеблется между неактивным состоянием, будучи связанным с ГДФ (Г—ГДФ), и активным состоянием, будучи связанным с ГТФ (Г4"—ГТФ); только белки, находящиеся в активном состоянии, могут стимулировать (Гс) или ингибировать (Ги) активность АЦ. Каждый комплекс Г—ГТФ обладает внутренней активностью ГТФазы, которая превращает его в неактивный комплекс Г—ГДФ. Чтобы вернуть Г-белок в его активное состояние, стимулирующие или ингибирующие комплексы гормон—рецептор (НсРс и НиРи соответственно) способствуют замене ГДФ на ГТФ в месте связывания Г-белка с гуаниннуклеотидом. В то время как комплекс ГиР требуется для начальной стимуляции или ингибирования АЦ белками Гс или Гц, гормон может отсоединиться от рецептора независимо от регуляции АЦ, которая, напротив, зависит от длительности состояния связывания между ГТФ и соответствующим Г-белком, регулируемого его внутренней ГТФазой. Два бактериальных токсина регулируют активность аденилатциклазы, катализируя АДФ-рибозилирование Г-белков (см. текст). АДФ-рибозилирование Г с холерным токсином угнетает активность его ГТФазы, стабилизируя Гс в его активном состоянии и тем самым увеличивая синтез циклического АМФ. В противоположность этому АДФ-рибозилирование Ги коклюшным токсином предотвращает его взаимодействие с комплексом гнири и стабилизирует Ги в связанном с ГДФ неактивном состоянии; в результате этого коклюшный токсин предотвращает гормональное угнетение АЦ.
Координированная регуляция различных клеток и тканей первичным медиатором. В случае классической реакции на стресс «сражайся или беги» катехоламины связываются с b-адренорецепторами, расположенными в сердце, жировой ткани, кровеносных сосудах и многих других тканях и органах, включая печень. Если бы циклический АМФ не опосредовал большинство реакций на действие b-адренергических катехоламинов (например, увеличение частоты сердечных сокращений и сократимости миокарда, расширение сосудов, снабжающих кровью скелетную мускулатуру, мобилизация энергии из запасов углеводов и жиров), то совокупность огромного количества отдельных ферментов в тканях должна была бы обладать специфическими местами связывания для регуляции катехоламинами.
Аналогичные примеры биологических функций циклического АМФ можно было бы привести и в отношении других первичных медиаторов, приведенных в табл. 67-1. Циклический АМФ действует как внутриклеточный медиатор для каждого из этих гормонов, обозначая их присутствие на поверхности клетки. Подобно всем эффективным медиаторам, циклический АМФ обеспечивает простой, экономичный и высокоспециализированный путь передачи разнородных и сложных сигналов.
Гормончувствительная аденилатциклаза. Основным ферментом, опосредующим соответствующие эффекты этой системе, является Гормончувствительная аденилатциклаза. Этот фермент состоит по меньшей мере из пяти классов разделимых белков, каждый из которых внедрен в жировую двухслойную плазматическую мембрану (рис. 67-2).
На наружной поверхности клеточной мембраны обнаруживаются два класса гормональных рецепторов, Рс и Ри. Они содержат специфические участки распознавания для связывания гормонов, стимулирующих (Нс) или ингибирующих (Ни) аденилатциклазу.
Каталитический элемент аденилатциклазы (АЦ), обнаруживаемый на цитоплазматической поверхности плазменной мембраны, превращает внутриклеточный АТФ в циклический АМФ и пирофосфат. На цитоплазматической поверхности присутствуют также два класса гуаниннуклеотидсвязывающих регулирующих белков. Эти белки, Гс и Ги, опосредуют стимулирующее и ингибирующее действие, воспринимаемое рецепторами Рс и Ри соответственно.
Как стимулирующая, так и угнетающая парные функции белков зависят от их способности связывать гуанозинтрифосфат (ГТФ) (см. рис. 67-2). Только ГТФ-связанные формы Г-белков регулируют синтез циклического АМФ. Ни стимуляция, ни угнетение АЦ не являются постоянным процессом; вместо этого концевой фосфор ГТФ в каждом комплексе Г—ГТФ в конце концов гидролизируется, а Гс—ГДФ или Ги — ГДФ не могут регулировать АЦ. По этой причине стойкие процессы стимуляции или угнетения аденилатциклазы требуют непрерывного превращения Г—ГДФ в Г—ГТФ. В обоих проводящих путях комплексы гормон — рецептор (НсРс или НиРи) усиливают превращение ГДФ в ГТФ. Этот рециркуляционный во временном и пространственном отношениях процесс отделяет связывание гормонов с рецепторами от регуляции синтеза циклического АМФ, используя энергетические запасы в концевой фосфорной связи ГТФ для усиления действия комплексов гормон — рецептор.
Эта схема объясняет, каким образом несколько разных гормонов могут стимулировать или угнетать синтез циклического АМФ в пределах единичной клетки. Поскольку рецепторы по своим физическим характеристикам отличаются от аденилатциклазы, совокупность рецепторов, находящихся на поверхности клетки, определяет специфическую картину ее чувствительности к внешним химическим сигналам. Отдельная клетка может иметь три или более различных рецептора, воспринимающих угнетающее действие, и шесть или более отличающихся от них рецепторов, воспринимающих стимулирующее действие. И напротив, все клетки, по-видимому, содержат сходные (возможно, идентичные) компоненты Г и АЦ.
Молекулярные компоненты гормончувствительной аденилатциклазы обеспечивают контрольные точки для изменения чувствительности данной ткани к гормональной стимуляции. Как Р, так и Г-компоненты служат решающими факторами физиологической регуляции чувствительности к гормонам, и изменения Г-белков рассматривают как первичное поражение, возникающее при четырех обсуждаемых ниже заболеваниях.
Регуляция чувствительности к гормонам (см. также гл. 66). Повторное введение какого-либо гормона или лекарственного средства, как правило, вызывает постепенное повышение резистентности к их действию. Этот феномен носит разные названия: гипосенсибилизация, рефрактерность, тахифилаксия или толерантность.
Гормоны или медиаторы могут вызвать развитие гипосенсибилизации, являющейся рецепторспецифичной, или «гомологичной». Например, введение b-адренергических катехоламинов вызывает специфическую рефрактерность миокарда к повторному введению этих аминов, но не к тем лекарственным средствам, которые не действуют через b-адренорецепторы. Рецепторспецифическая гипосенсибилизация включает в себя по меньшей мере два отдельных механизма. Первый из них, быстро развивающийся (в течение нескольких минут) и быстро обратимый при удалении введенного гормона, функционально «расцепляет» рецепторы и Гс-белок и, следовательно, снижает их способность стимулировать аденилатциклазу. Второй процесс связан с фактическим уменьшением числа рецепторов на клеточной мембране — процесс, называемый рецептороуменьшающей регуляцией. Процесс рецептороуменьшающей регуляции для своего развития требует несколько часов и является труднообратимым.
Процессы гипосенсибилизации представляют собой часть нормальной регуляции. Устранение нормальных физиологических стимулов может привести к повышению чувствительности ткани-мишени к фармакологической стимуляции, как это происходит при развитии гиперчувствительности, вызванной денервацией. Потенциально важная клиническая корреляция такого увеличения числа рецепторов может развиться у больных при внезапном прекращении лечения анаприлином, являющимся b-адреноблокирующим средством. У таких больных часто наблюдаются преходящие признаки повышенного симпатического тонуса (тахикардия, повышение артериального давления, головные боли, дрожание и т. д.) и могут развиться симптомы коронарной недостаточности. В лейкоцитах периферической крови больных, получающих анаприлин, обнаруживают повышенное число b-адренорецепторов, и число этих рецепторов медленно возвращается к нормальным значениям при прекращении приема препарата. Хотя более многочисленные другие рецепторы лейкоцитов не опосредуют сердечно-сосудистые симптомы и явления, возникающие в случае отмены анаприлина, рецепторы в миокарде и других тканях, вероятно, претерпевают такие же изменения.
Чувствительность клеток и тканей к гормонам может регулироваться и «гетерологичным» путем, т. е. когда чувствительность к одному гормону регулируется другим гормоном, действующим через иной набор рецепторов. Регуляция чувствительности сердечно-сосудистой системы к b-адренергическим аминам гормонами щитовидной железы является самым известным клиническим примером гетерологичной регуляции. Гормоны щитовидной железы вызывают накопление избыточного количества b-адренорецепторов в миокарде. Это увеличение. числа рецепторов частично объясняет повышенную чувствительность сердца больных гипертиреозом к катехоламинам. Однако тот факт, что у экспериментальных животных увеличение числа b-адренорецепторов, вызываемое введением гормонов щитовидной железы, недостаточно для того, чтобы отнести на его счет повышение чувствительности сердца к катехоламинам, позволяет предположить, что влиянию гормонов щитовидной железы подвержены также и компоненты реакции на гормоны, действующие дистальнее рецепторов, возможно включающие в себя Гс, но не ограничивающиеся этими субъединицами. К числу других примеров гетерологичной регуляции относятся контролирование эстрогеном и прогестероном чувствительности матки к расслабляющему действию b-адренергических агонистов и повышенная реактивность многих тканей по отношению к адреналину, вызываемая глюкокортикоидами.
Второй тип гетерологичной регуляции заключается в угнетении гормональной стимуляции аденилатциклазы веществами, действующими через Ри и Ги, как отмечалось выше. Ацетилхолин, опиаты и a-адренергические катехоламины действуют через отличные друг от друга классы воспринимающих ингибирующее действие рецепторов (мускариновые, опиатные и a-адренорецепторы), снижая чувствительность аденилатциклазы определенных тканей к стимулирующему действию других гормонов. Хотя клиническое значение гетерологичной регуляции этого типа не установлено, угнетение синтеза циклического АМФ морфином и другими опиатами могло бы быть причиной некоторых аспектов толерантности к препаратам этого класса. Аналогично устранение такого угнетения может играть определенную роль в развитии синдрома, следующего за прекращением введения опиатов.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1937; Нарушение авторских прав?; Мы поможем в написании вашей работы!