
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Парасимпатическая нервная система 3 страница
|
|
|
|
Влияние на пищеварительный тракт. Простагландины серии Е оказывают влияние также на пищеварение. Введение любого из простагландинов ППг или ПГЕг в желудочную артерию собак вызывет увеличение кровотока и угнетение выделения кислоты, а при пероральном приеме некоторые аналоги ПГЕ одновременно угнетают выделение кислоты и оказывают прямое защитное действие на слизистую оболочку пищеварительного тракта. В экспериментах in vitro Простагландины стимулируют гладкую мускулатуру пищеварительного тракта и тем самым повышают его двигательную активность, но не совсем ясно, имеют ли эти эффекты физиологическое значение.
Нейропередача. ПГЕ угнетает выход норадреналина из симпатических нервных окончаний. Действие ПГЕ на секрецию этого нейромедиатора, по-видимому, осуществляется на пресинаптическом уровне, т. е. в участке нервного окончания, расположенном проксимальнее синаптической щели; оно может быть обратимо при увеличении концентрации кальция в перфузионной среде. Поэтому ПГЕг способен подавлять высвобождение норадреналина путем блокирования поступления кальция внутрь клетки. Ингибиторы синтеза ПГЕг усиливают высвобождение норадреналина в ответ на стимуляцию адренергических нервов.
Катехоламины обладают способностью высвобождать ПГЕг из различных тканей, и происходит это, вероятно, посредством адренергически-опосредованного механизма. Например, в иннервированных тканях, таких как ткани селезенки, нервная стимуляция или инъекция норадреналина вызывает высвобождение ПГЕг. Это высвобождение блокируется после денервации или введения а-адрено-блокирующих средств. Таким образом, активирующий нерв стимул вызывает освобождение норадреналина, который в свою очередь стимулирует синтез и высвобождение ПГЕг; затем ПГЕг посредством обратной связи действует на пресинаптическом уровне на нервное окончание, уменьшая количество высвобождаемого норадреналина.
Эндокринная функция поджелудочной железы. ПГЕг оказывает как стимулирующее, так и угнетающее влияние на секрецию инсулина b-клетками поджелудочной железы in vitro. In vivo ПГЕ2 подавляет реакцию инсулина на внутривенное введение глюкозы. Это подавление, по-видимому, является специфичным по отношению к глюкозе, потому что реакция инсулина на другие средства, усиливающие секрецию, под действием ПГЕ2 не изменяется. Предположение о том, что эндогенный ПГЕ2 in vivo угнетает секрецию инсулина, подтверждается исследованиями ингибиторов синтеза простагландина. Обычно такие лекарственные средства усиливают секрецию инсулина и увеличивают толерантность к углеводам. Исключением является индометацин, который подавляет вызываемую глюкозой секрецию инсулина и может вызвать развитие гипергликемии. Такие противоречивые результаты исследований индометацина, вероятно, обусловлены каким-то иным действием, помимо угнетения циклооксигеназы. Липооксигеназный путь, по-видимому, играет роль в усилении секреции инсулина, участвуя в процессе стимул-секреции. В этом случае вероятным активным продуктом арахидоновой кислоты может быть 12-ГПЭТЕ.
Лютеолиз. Экстирпация матки во время лютеальной фазы яичникового цикла у овец приводит к сохранению желтого тела. Это позволяет предположить, что маткой в норме вырабатывается лютеолитическое вещество. Можно предположить, что этим веществом является ПГЕ2, поскольку он может вызывать регрессию желтого тела.
Патофизиология метаболитов арахидоновой кислоты. В большинстве случаев развитие какого-либо заболевания сопровождается чрезмерно высоким уровнем продуцирования метаболитов арахидоновой кислоты, но некоторые нарушения могут быть связаны и со сниженным их продуцированном. Последнее может произойти в результате: недостатка употребления арахидоновой кислоты (незаменимой жирной кислоты с пищей); повреждения ткани, необходимой для синтеза простагландинов, или вследствие лечения лекарственными средствами, угнетающими ферменты в цепи синтеза.
Резорбция костей: гиперкальциемия, обусловленная злокачественным заболеванием (см. также гл. 303 и 336). Гиперкальциемия развивается при различных злокачественных заболеваниях паращитовидных желез. В ряду случаев причиной может служить избыток гормона паращитовидных желез в результате или автономного продуцирования его тканью паращитовидных желез, или эктопического образования самой опухолью. Однако у большинства больных, страдающих гиперкальциемией, обусловленной злокачественным заболеванием, не отмечается повышенного уровня содержания гормона паращитовидных желез в плазме крови, так что этиология этой гиперкальциемии находится в сфере повышенного интереса.
Простагландин Е2 является мощным пусковым механизмом резорбции костей и высвобождения из них кальция. У животных, страдающих гиперкальциемией, которым были трансплантированы опухоли, отмечается повышенное продуцирование ПГЕ2. Лечение этих животных ингибиторами синтеза ПГЕ2 приводит к снижению концентрации этого простагландина и одновременному снижению уровня гиперкальциемии. Подобно этому, у некоторых больных, страдающих гиперкальциемией и злокачественными опухолями, определяется большое количество метаболитов ПГЕ2 в моче, в то время как у больных с нормальной концентрацией кальция в крови и страдающих аналогичными злокачественными опухолями, такого повышения уровня содержания метаболитов ПГЕ2 в моче не отмечается. Лекарственные средства, подавляющие синтез простагландинов. снижают концентрацию кальция в крови у некоторых больных, страдающих гиперкальциемией, обусловленной злокачественным заболеванием. Таким образом, приблизительно у 5—10% больных с гиперкальциемией и злокачественными опухолями отмечают повышенный уровень продуцирования ПГЕ, и им может быть показана терапия лекарственными средствами, угнетающими синтез простагландинов.
Источник избыточного количества ПГЕ2 в крови у таких больных не выявлен. Следовало бы ожидать компенсации этого избытка путем повышенного уровня расщепления ПГЕ в печени и легких. Однако возможно, что опухолью высвобождаются в циркулирующую кровь настолько большие количества ПГЕ2, что расщепление его в печени и легких оказывается недостаточным, чтобы скомпенсировать такую нагрузку. При наличии метастазов в легких венозный отток от этих опухолей может вливаться в большой круг кровообращения, минуя легочную ткань. Другим возможным механизмом является метастатическое поражение костей. Опухолевые клетки в культуре синтезируют ПГЕ, метастатические опухолевые клетки в кости также могут синтезировать этот простагландин, который будет действовать локально, вызывая резорбцию кости. Гиперкальциемия, обусловленная злокачественным заболеванием, может развиться и при отсутствии видимых костных метастазов, хотя следует отметить, что существующие в настоящее время клинические методы визуализации подобных метастазов, такие как радиоизотопное сканирование, могут оказаться недостаточно чувствительными для выявления многих очагов поражения с небольшими размерами.
Резорбция кости: ревматоидный артрит и зубная киста (см. гл. 263). Было установлено, что избыточное продуцирование ПГЕ2 служит причиной юкстаартикулярного остеопороза и эрозий костей у некоторых больных, страдающих ревматоидным артритом. Пораженные ревматизмом синовиальные оболочки синтезируют ПГЕ2 в культуре тканей, культуральная среда которых способна вызывать резорбцию кости; добавление же индометацина в среду для культивирования таких клеток блокирует эту способность к резорбции. Поскольку индометацин не предотвращает резорбцию костей, обусловленную ранее образовавшимся ПГЕ2, предполагают, что за эту резорбционную активность ответствен ПГЕ2, вырабатываемый в синовиальных оболочках.
Клетки доброкачественных зубных кист также вызывают резорбцию кости и синтезируют ПГЕ2 в культуре тканей. И в этом случае резорбцию, вызванную средой из этих культур, можно уменьшить добавлением в нее индометацина перед инкубацией. Сходной проблемой является резорбция костной ткани зубных альвеол у больных, страдающих пародонтозом, распространенным воспалительным, заболеванием десен. Уровни содержания ПГЕ2 в десне при воспалении выше, чем в здоровых тканях. Таким образом, вероятно, что резорбция костных тканей зубных альвеол может быть обусловлена, по меньшей мере отчасти, локальным избыточным продуцированном этих метаболитов.
Синдром Бартера (см. гл. 228). Синдром Бартера характеризуется повышенными уровнями содержания ренина, альдостерона и брадикинина в плазме крови; резистентностью к прессорному действию ангиотензина; гипокалиемическим алкалозом и опустошением запасов калия в почках при наличии нормального артериального давления. Основанием для постулированной роли простагландинов при этом заболевании является то, что ПГЕ2 и ПГI2 стимулируют высвобождение ренина и прессорная реакция на введенный ангиотензин притупляется сосудорасширяющими эффектами этих простагландинов. Увеличение высвобождения ренина ведет к повышенной секреции альдостероца, которая в свою очередь может увеличить активность калликреина в моче.
В соответствие с этим в моче страдающих синдромом Бартера больных отмечают повышенные уровни содержания ПГЕ2 и б-кето-ПГF1a. У таких больных была выявлена также и гиперплазия интерстициальных клеток мозгового вещества почек (которые синтезируют ПГЕ в культуре). Выявление этих фактов привело к попыткам лечения этого заболевания ингибиторами синтеза простагландинов. Индометацин (и другие ингибиторы) устраняет фактически все нарушения, за исключением гипокалиемии. Таким образом, простагландин (вероятно, ПГЕ2 и/или ПГI2), возможно, опосредует некоторые проявления синдрома Бартера.
Сахарный диабет (см. гл. 327). Внутривенное введение больших количеств глюкозы здоровым людям вызывает резкое (первая фаза) увеличение секреции инсулина в плазму крови, за которым следует более медленная и более длительная реакция (вторая фаза секреции инсулина). У больных, страдающих сахарным диабетом типа II (инсулиннезависимый, развитие которого начинается в зрелом возрасте), отсутствует первая фаза высвобождения инсулина в ответ на введение глюкозы и отмечается непостоянная степень снижения секреции инсулина во второй фазе. Реакция инсулина на другие вещества, стимулирующие секрецию, такие как аргинин, изарин, глюкагон и секретин, сохраняется. Таким образом, у больных диабетом, по-видимому, имеется специфический дефект, препятствующий нормальному восприятию сигналов от глюкозы. Поскольку ПГЕ угнетает индуцированную глюкозой секрецию инсулина у здоровых людей, то больным сахарным диабетом типа II назначали ингибиторы синтеза эндогенного простагландина с целью определить, происходит ли при этом восстановление секреции инсулина. Как натрия салицилат, так и ацетилсалициловая кислота повышают базальные уровни содержания инсулина в плазме крови и частично восстанавливают первую фазу реакции инсулина на глюкозу; увеличивается секреция инсулина и во второй фазе, повышается толерантность к глюкозе.
Незаращение артериального протока (см. гл. 185). В экспериментах на животных установлено, что артериальный проток у овец чувствителен к сосудорасширяющим свойствам ПГЕ2, а в тканях стенки протока присутствуют ПГЕ-подобные вещества. Таким образом, сохранять артериальный проток незаращенным в пренатальном периоде может повышенная концентрация эндогенного ПГЕ2. Поскольку ингибиторы синтеза простагландина вызывают сужение артериального протока у плодов овец, были предприняты попытки введения индометацина недоношенным детям с изолированным незаращенным артериальным протоком. После нескольких суток такого лечения последовало закрытие просвета протока у большинства детей, хотя некоторым из них для этого потребовался второй курс лечения, а у небольшого числа детей сохранилась необходимость выполнить хирургическую перевязку артериального протока. Наиболее вероятно получение благоприятного результата лечения индометацином у детей, срок внутриутробного развития которых не превышает 35 недель.
Больным с врожденными пороками сердца определенных типов для выживания необходимо наличие незаращенного артериального протока. Это является жизненно важным в таких случаях, когда артериальный проток является основным каналом, по которому неоксигенированная кровь из дуги аорты достигает легких, например, при атрезии легочной артерии и атрезии.правого предсердно-желудочкового клапана. Поскольку ПГЕ расслабляет гладкую мускулатуру в артериальном протоке ягнят, были сделаны клинические попытки внутривенного введения ПГЕ с целью поддержания артериального протока у таких больных в незаращенном состоянии в качестве альтернативы немедленному хирургическому вмешательству. Подобное введение ПГЕ вызывает кратковременное увеличение притока крови к легким и повышение насыщения артериальной крови кислородом, до тех пор пока не появится возможность выполнения необходимой корригирующей операции на сердце. Наличие значительного объема праволевого шунтирования при таких пороках сердца позволяет избежать расщепления внутривенно введенного ПГЕ2 в легких, прежде чем он попадет в артериальный проток. В этом случае характер заболевания сам по себе облегчает доставку лекарственного средства к месту его действия.
Язвенная болезнь желудка (см. гл. 235). Повышенная секреция кислоты в желудке у людей, страдающих язвенной болезнью, вносит свой вклад в повреждение слизистой оболочки органа. Существуют различные аналоги ПГЕ2, которые угнетают секрецию соляной кислоты в желудке и являются по своей природе также и цитопротекторами. Эти вещества более эффективны, чем плацебо, для устранения болей и снижения секреции кислоты в желудке у страдающих язвенной болезнью людей. Кроме того, сообщалось об ускорении заживления язв, оцениваемом эндоскопически, у больных, получавших аналоги ПГЕ, по сравнению с больцыми, получавшими плацебо.
Дисменорея (см. гл. 331). Как правило, дисменорея связана с усилением сократимости матки. Тот факт, что некоторые анальгетики, используемые для лечения этого заболевания, также угнетают синтез простагландина, позволяет предположить, что в патогенезе дисменореи определенную роль могут играть метаболиты арахидоновой кислоты. Простагландины серий Е и F присутствуют в эндометрии у женщин. Внутривенное введение любого из них вызывает сокращение матки, а уровни содержания ПГF и ПГЕ в менструальной крови снижаются после введения ингибиторов синтеза простагландина. Результаты контролируемых исследований по сравнению эффективности ингибиторов синтеза простагландина и плацебо у страдающих дисменореей женщин показывают более выраженное симптоматическое улучшение после лекарственной терапии.
Астма (см. гл. 202).
Воспалительная реакция и иммунный ответ (см. гл. 62 и 260). Такие лекарственные средства, как, например, ацетилсалициловая кислота, обладают жаропонижающим, противовоспалительным и аналгезирующим действием. Существует несколько доводов в пользу наличия связи между воспалением и метаболитами арахидоновой кислоты: 1 — воспалительные стимулы, такие как гистамин и брадикинин, одновременно с индуцированном воспаления вызывают и высвобождение эндогенных простагландинов; 2 — лейкотриены C4-D4-E4 обладают более сильным, чем гистамин, бронхоспастическим действием; 3 — некоторые метаболиты арахидоновой кислоты вызывают расширение сосудов и гипералгезию; 4 — в очагах воспаления выявляют присутствие ПГЕ2 и ЛТВ4; полиморфно-ядерные клетки высвобождают эти вещества во время фагоцитоза, а они в свою очередь вызывают хемотаксис лейкоцитов; 5 — некоторые простагландины вызывают увеличение сосудистой проницаемости, являющейся характерной чертой воспалительной реакции, приводящей к местному отеку; 6 — индуцированное ПГЕ расширение сосудов не устраняется атропином, анаприлином, метисергидом (Methysergide) или антигистаминными средствами, являющимися известными антагонистами других возможных медиаторов воспалительной реакции; таким образом, ПГЕ может оказывать прямое воспалительное действие, а некоторые медиаторы воспаления могут функционировать, оказывая влияние на высвобождение ПГЕ; 7 — некоторые метаболиты арахидоновой кислоты могут вызвать боль у экспериментальных животных и гипералгезию, или повышенную болевую чувствительность у человека; 8—ПГЕ может привести к развитию лихорадки после его введения в желудочки головного мозга или в гипоталамус экспериментальных животных; 9 — пирогенные вещества вызывают повышение концентрации простагландинов в цереброспинальной жидкости, в то время как ингибиторы синтеза простагландина уменьшают интенсивность лихорадки и снижают высвобождение простагландинов в цереброспинальную жидкость.
Метаболиты арахидоновой кислоты также играют определенную роль в иммунном ответе. Небольшие количества ПГЕ2 могут подавлять стимуляцию лимфоцитов у человека, вызываемую такими митогенными веществами, как фитогемагглютинин, а воспалительная реакция бывает связана с локальным высвобождением метаболитов арахидоновой кислоты; таким образом, эти вещества могут действовать как негативные модуляторы функции лимфоцитов. Высвобождение ПГЕ митогенстимулированными лимфоцитами может представлять собой часть контрольного механизма обратной связи, посредством которого реализуется активность лимфоцитов. Чувствительность лимфоцитов к угнетающему действию ПГЕ2 у человека повышается с возрастом, а индометацин увеличивает чувствительность лимфоцитов к действию митогенов в большей степени у пожилых людей. Культура лимфоцитов, взятых у страдающих лимфогранулематозом больных, высвобождает больше ПГЕ2 после добавления фитогемагглютинина, а чувствительность лимфоцитов увеличивается под действием индометацина. Если удалить супрессорные Т-лимфоциты из соответствующих культур, то количество синтезируемого ПГЕ2 уменьшается, а чувствительность лимфоцитов, взятых у больных, лимфогранулематозом и у здоровых людей, становится одинаковой. Подавление клеточного иммунитета у страдающих лимфогранулематозом больных может быть результатом угнетения простагландином Е функции лимфоцитов.
ГЛАВА 69. ЭНДОГЕННЫЕ ОПИАТНЫЕ ПЕПТИДЫ
Майкл Розенблатт (Michael Rosenblatt)
Эндогенные опиатные пептиды — энкефалины и эндорфины — присутствуют в гипоталамусе и в головном мозге, в эндокринных железах (гипофизе, надпочечниках, яичниках и семенниках) и в пищеварительном тракте (включая поджелудочную железу). Эти пептиды составляют класс, состоящий приблизительно из 10—15 веществ, молекула каждого из которых включает в себя от 5 до 31 аминокислоты. Некоторые из них делят общие пути биосинтеза и секреции с такими гормонами, как адренокортикотропный (АКТГ), а-меланоцитостимулирующий (a-МСГ), b-меланоцитостимулирующий (b-МСГ) и b-липотропный (b-ЛПГ). Они обладают: 1 — морфиноподобным анальгезирующим действием; 2 — влиянием на поведенческие реакции; 3 — способностью функционировать в качестве нейромедиаторов и нейромодуляторов. Действительно, эти пептиды могут играть определенную роль в осуществлении многих функций, таких как память, способность к облучению, реакция на стресс, размножение, передача болевых импульсов и регуляция аппетита, температуры тела и дыхания (табл. 69-1). Кроме того, с действием энкефалинов и эндорфинов могут быть связаны реакция на плацебо, обезболивание посредством акупунктуры, индуцированная стрессом аменорея и патогенез шока. Во взаимосвязи с эндорфинами могут находиться и такие феномены, как седативное действие, раздражительность, возбуждение, буйное поведение, каталепсия, нарколепсия и кататония. Другие поведенческие феномены, такие как привычка к курению, алкоголизм, наркомания, могут отражать биохимические нарушения в этой системе.
Таблица 69 1. Биологические эффекты и возможная роль эндогенных опиатов в различных физиологических феноменах
Обезболивание
Состояние, подобное кататонии
Судорожные припадки
Регуляция температуры тела
Контроль за аппетитом функция размножения (эндокринная)
Сексуальное поведение
Снижение артериального давления
Реакция на стресс
Высвобождение гормонов гипоталамуса/гипофиза
Изменение памяти
Регуляция дыхания
Модулирование иммунного ответа
Изучение энкефалинов и эндорфинов началось с обнаружения опиатных рецепторов, которые были выявлены и охарактеризованы до того, как были выделены первые эндогенные опиатные пептиды. Существование рецепторов, связывающих алкалоиды опиума, такие как морфин, в центральной нервной системе и других тканях вызвало к жизни телеологический вопрос о причине их существования. Кажется невероятным, чтобы эти рецепторы существовали для обеспечения взаимодействия с экзогенно вводимыми лекарственными средствами; было постулировано существование эндогенных веществ с морфиноподобными свойствами и были предприняты усилия для их выявления.
В 1975 г. Hughes и Kosteriitz с соавт. опубликовали сообщение об открытии ими двух небольших (молекулы состоят из 5 аминокислот) пептидов головного мозга, которые связываются с опиатными рецепторами и являются более сильнодействующими веществами, чем морфин. Они назвали эти вещества энкефалинами (что означает «в голове»). Через несколько месяцев из гипоталамо-гипофизарных экстрактов было выделено еще три опиатных пептида, размер молекулы которых был больше, чем у молекул энкефалинов, и их назвали эндорфинами (сокращение от слов «эндогенный морфин»). Позднее к этому списку были добавлены динорфин, a-неоэндорфин и другие вещества. Термин «эндорфин» используется некоторыми авторами в качестве общего названия всех опиатных пептидов.
Строение и биосинтез. Строение некоторых эндогенных опиатов показано на рис. 69-1. Хотя эти вещества химически не родственны морфину, исследования с моделированием соответствующих молекул показывают, что молекула морфина может принимать форму, сходную с гипотетической формой молекул энкефалинов и эндорфинов, которую они могут приобретать в момент их взаимодействия с рецептором.
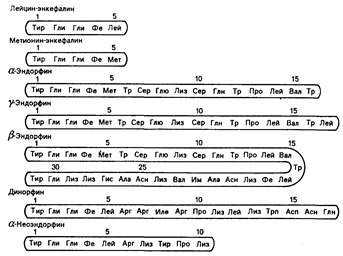
Рис. 69-1. Строение некоторых эндогенных опиатных пептидов.
Четыре аминокислоты, составляющие аминоокончание (слева), одинаковы в каждом пептиде. В положении 5 обнаруживают метионин или лейцин.
По своему строению эти вещества идентичны друг другу по четырем аминокислотам в их аминоокончаниях, которые представляют собой «активный центр» молекулы, хотя каждое из этих веществ обладает различным биологическим действием. Эндорфины как класс лучше связываются с опиатными рецепторами, чем сам морфин, и они проявляют себя в 20—700 раз более сильнодействующими, чем алкалоиды морфина, в различных исследованиях их биологической активности, проводимых как in vitro, так и in vivo. В ряде случаев высокая лабильность может привести к недооценке величины их действия: она является результатом ферментного расщепления энкефалинов, веществ, имеющих наименьшие размеры молекулы.
Хотя опиатные пептиды имеют общие химические особенности, пути их биосинтеза различны. Синтез b-эндорфина (количество которого в организме наибольшее из всех эндорфинов) в гипофизе происходит как часть синтеза более крупной молекулы-предшественника (проопиомеланокортина, или ПОМК), которая также содержит полную последовательность актг, a-МСГ, b-МСГ и b-ЛПГ (рис. 69-2). Эта молекула-предшественник обладает также способностью образовывать другие формы эндорфина — фрагменты, называемые a-эндорфином и g-эндорфином. Внутри ПОМК существуют места отщепления «прогормоноподобных» веществ, что позволяет образоваться каждому из упомянутых выше пептидов в некоторых анатомических областях. Отсюда следует, что р-липотропный гормон, вероятно, является прогормоном для b-эндорфина. Хотя b-липотропный гормон обладает собственным спектром биологических свойств, его физиологическое значение у человека не определено. Важнее всего уяснить, что этот путь биосинтеза представляет собой единственный способ, посредством которого гипофиз продуцирует АКТГ. Следовательно, биосинтез АКТГ и биосинтез b-эндорфина сложным образом связаны между собой в гипофизе происхождением от одного и того же гена, который кодирует оба гормона. Всегда, когда в гипофизе секретируется АКТГ, там также происходит секреция b-эндорфина.
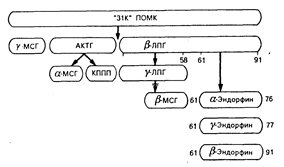
Рис. 69-2. Схема биосинтеза b-эндорфина в гипофизе.
Первоначальному синтезу единичного белка-предшественника — проопиомеланокортина (ПОМК) (мол. масса около 31 000) — способствует трансляция гена, кодирующего структуру адренокортикотропного гормона (АКТГ), b-липотропного гормона (b-ЛПГ) и b-эндорфина. Полученные в результате расщепления прогормоноподобные вещества могут генерировать образование других гормонов из того же самого предшественника, хотя такой процесс происходит не в гипофизе, а в других тканях. МСГ — меланоцитстимулирующий гормон; ЛПГ — липотропный гормон; КППП — кортикотропиноподобный промежуточный пептид; АКТГ — адренокортикотропный гормон.
В разных тканях происходят дифференцированные превращения ПОМК. Такое превращение может включать в себя метаболическую инактивацию пептидов, генерируемых из молекулы-предшественника в определенных анатомических областях. Например, хотя в гипофизе не происходит превращения AKTГ в более мелкие фрагменты, в гипоталамусе молекула-предшественник превращается в a-МСГ. b-МСГ генерируется в промежуточной доле мозга у животных низших видов. У человека отсутствует промежуточная доля мозга как четко выраженное единое анатомическое образование, и поэтому b-МСГ у человека продуцируется только в отдельных разрозненных клетках гипофиза. Эти клетки гипофиза секретируют b-эндорфин, b-липотропный гормон и АКТГ. В других клетках конечные продукты секреции определяются видом расщепления большой молекулы пептида-предшественника ферментными системами внутри этих клеток. Хотя клетки нескольких типов могут синтезировать один и тот же первичный генный продукт, конечный профиль гормональной секреции может быть совершенно разным.
Энкефалины ведут свое происхождение от разных предшественников, например в надпочечниках происходит биосинтез энкефалина, представляющего собой часть большой молекулы (мол. масса 50000) белка, — проэнкефалина-А, в котором содержится шесть повторов последовательности мет-энкефалина и одна структура лей-энкефалина (рис. 69-3). И снова типичные места отщепления «прогормоноподобных» веществ будут обусловливать структуру энкефалина. Динорфины и неоэндорфины ведут свое происхождение от третьей отдельной молекулы-предшественника — проэнкефалина-В. В структурах этих белков-предшественников закодированы дополнительные («загадочные») пептиды и они могут быть синтезированы в результате расщепления «прогормоноподобных» веществ. Неизвестно, секретируются ли эти таинственные пептиды in vivo, но некоторые из них были синтезированы химическим путем и, как установлено, могут оказывать биологическое действие.
Механизм действия. Как и для других пептидных гормонов, первый этап проявления биологической активности опиатных пептидов состоит в их связывании со специфическими рецепторами на плазматической мембране клеток-мишеней. Были охарактеризованы по меньшей мере пять функциональных типов опиатных рецепторов: взятые вместе с многочисленными видами эндогенных опиатных пептидов, они образуют очень сложную систему. Эта сложность еще более возрастает из-за различий в ответной реакции (десенсибилизация, толерантность и т. д.) на действие данного опиата на протяжении времени или в зависимости от вида его воздействия на рецепторы и вследствие того, что единичный нейрон (или эндокринная клетка) может секретировать более одного нейромедиатора.
Взаимодействие с рецептором ведет к образованию вторичного медиатора. Для опиатной системы взаимодействие с рецептором обычно приводит к снижению как базальной, так и стимулированной концентрации циклического АМФ, а длительное воздействие опиатными пептидами вызывает долговременное снижение его внутриклеточной концентрации. Однако в качестве компенсаторной реакции с течением времени постепенно число единиц аденилатциклазы возрастает. Это биохимическое изменение может физиологически коррелировать с толерантностью и тахифилаксией, требующими высоких доз опиатов для снижения уровней содержания циклического АМФ. Внезапная отмена опиатов в то время, когда клетка обогащена аденилатциклазой, устраняет угнетение этих единиц, что приводит к резкому повышению концентраций циклического АМФ и, возможно, вносит свой вклад в развитие синдрома отмены опиатов.
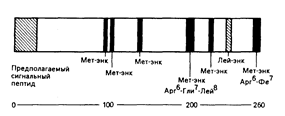
Рис. 69-3. Биосинтез предшественника энкефалинов (пре-проэнкефалин А) в надпочечнике.
Белок-предшественник содержит 260 аминокислот и имеет мол. массу около 50000. Отщепление «прогормоноподобных» веществ способно привести к образованию шести копий метионин—энкефалина (Мет—энк) и одной копии лейцин—энкефалина (.Лей—энк) из одной молекулы предшественника. Характеристикой секретируемых белков служит сигнальная пептидная последовательность в аминокислотном окончании (слева) белка-предшественника.
Эндокринология эндогенных опиатных пептидов. Эндокринная физиология. Биосинтез и секреция гипофизом АКТГ, b-эндорфина и b-липотропного гормона связаны как с нормальным, так и с патофизиологическим состоянием организма. При нормальном состоянии организма b-липотропный гормон циркулирует в крови в более высоких молярных концентрациях, чем b-эндорфин, но применявшимися радиоиммунными методами клинических исследований оба эти вещества определяются суммарно. Таким образом, уровни содержания иммунореактивного b-эндорфина отражают суммарные уровни содержания b-эндорфина и b-липотропного гормона. Такие радиоиммунные исследования обеспечивают получение клинических данных о связи биосинтеза АКТГ и биосинтеза р-эндорфина. Например, при аддисоновой болезни уровни содержания в плазме крови как АКТГ, так и иммунореактивного b-эндорфина повышены; аналогично заместительная терапия глюкокортикоидами уменьшает уровни содержания как АКТГ, так и b-эндорфина. Введение либерина кортикотропного гормона (ЛКГ) стимулирует высвобождение как АКТГ, так и иммунореактивного b-эндорфина одновременно. При синдроме Нельсона (развитии опухоли гипофиза после двусторонней адреналэктомии по поводу болезни Кушинга) повышены концентрации в плазме крови как АКТГ, так и иммунореактивного b-эндорфина. Эктопическое продуцирование актг опухолями сопровождается также избыточным содержанием иммунореактивного b-эндорфина. В последнем случае измерение уровня содержания иммунореактивного b-эндорфина может быть использовано в качестве маркера опухоли и в некоторых случаях служит для контролирования результатов лечения.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 632; Нарушение авторских прав?; Мы поможем в написании вашей работы!