
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм экскреторной функции почек при нормальной и сниженной массе нефронов 3 страница
|
|
|
|
Патология. Изменения, наблюдаемые в почках больных с острой почечной недостаточностью, различны. Световая микроскопия позволяет выявить лишь явные изменения. Это могут быть различные степени некроза канальцев с поврежденным, некротическим или регенерирующим эпителием канальцев, внутриканальцевые цилиндры, интерстициальный отек -и интерстициальная клеточная инфильтрация; коллапс канальцев или их расширение. Если у больного не наблюдают диссеминированной внутрисосудистой коагуляции или тяжелого, длительного ишемического воздействия, то при световой и электронной микроскопии не выявляют повреждений внутрипочечных кровеносных сосудов и почечных клубочков. Гистологическими исследованиями установлено существование двух основных типов поражений почек. В результате прямого нефротоксического действия наблюдается однородный, диффузный некроз клеток извитых и прямых проксимальных канальцев. Базальная мембрана канальцев остается неповрежденной. Напротив, ишемия почек приводит к развитию слабого, пятнистого некроза по всему нефрону, наиболее выраженному в тех отделах канальцев, которые находятся на границе коры и мозгового вещества. Особенно ранимыми являются юкстамедуллярный прямой проксимальный каналец и толстая восходящая часть петли нефрона, находящаяся в мозговом веществе. Наблюдается также разрыв базальной мембраны канальцев. Несмотря на эти гистологические различия, клиническое течение нефротоксической и ишемической острой почечной недостаточности сходно. Строгой корреляции между гистопатологическими изменениями в почках и их функциональными параметрами при острой почечной недостаточности часто нет. Исследования биоптата почек, проведенные после выздоровления больного, выявляют лишь незначительные изменения или дают нормальные результаты.
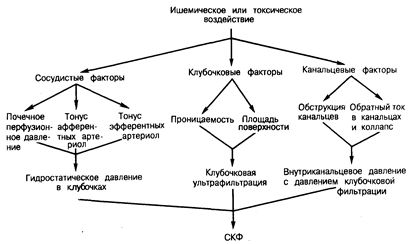
Рис. 219-1. Возможная схема патогенеза острой почечной недостаточности.
Дифференциальная диагностика (см. табл. 219-1). Диагноз острой почечной недостаточности ставят методом исключения, поскольку любое из преренальных (гипоперфузия почек), постренальных (непроходимость мочевых путей) и других внутрипочечных нарушений (гломерулонефрит, поражение сосудов и интерстициальной ткани почек) может вызвать развитие идентичного клинического синдрома нарушения функции почек. Однако в отличие от острой почечной недостаточности, преренальные, постренальные и другие внутрипочечные повреждения клубочков или сосудов поддаются специфической коррекции.
Нарушение перфузии почек, развившееся в результате внепочечных причин, может привести к такому снижению уровня клубочковой фильтрации, при котором будет невозможно обеспечить экскрецию суточного количества эндогенных продуктов азотного обмена. Азотемия может оказаться обратимой, если будет устранена причина почечной ишемии. Для этого может потребоваться увеличить объем внеклеточной жидкости, минутный объем сердца или восстановить нормальное почечное перфузионное давление. В таком случае для постановки диагноза необходимо провести сбор данных анамнеза, установить возможное снижение массы тела и объема внеклеточной жидкости или ее секвестрации, а также выявить симптомы нарушения минутного объема сердца у больных с нарушенной функцией почек. Кроме того, следует тщательно обследовать больного, причем особое внимание надо уделить выявлению ортостатической гипотензии и тахикардии, определить давление в яремных венах, тургор кожи, исследовать состояние слизистых оболочек и функцию сердца.
Таблица 219-1. Основные причины развития острой почечной недостаточности
| Нарушение | Пример |
| Преренальная недостаточность | |
| Гиповолемия | Уменьшение объема крови, притекающей к коже, пищеварительному тракту или почкам; кровотечение; секвестрация внеклеточной жидкости (ожоги, панкреатит, перитонит) |
| Сердечно-сосудистая недостаточность | Нарушение минутного объема сердца (инфаркт, тампонада); задержка крови в сосудах (анафилаксия, сепсис, лекарственные средства) |
| Постренальная недостаточность | |
| Внепочечная обструкция | Окклюзия мочеиспускательного канала, опухоли мочевого пузыря, тазовых органов, предстательной железы или забрюшинного пространства; простатизм; несчастный случай при хирургической операции; действие лекарственных средств; камни; гной; кровяные тромбы |
| Внутрипочечная обструкция | Кристаллы (мочевая кислота, щавелевая кислота, сульфаниламиды, метотрексат) |
| Разрыв мочевого пузыря | Травма |
| Специфические болезни почек | |
| Болезни сосудов | Васкулит; злокачественная гипертензия; болезнь Мошковича; склеродермия; артериальная и/или венозная окклюзия |
| Гломерулонефрит | Болезнь иммунных комплексов; поражение клубочковой базальной мембраны |
| Интерстициальный нефрит | Лекарственные средства; гиперкальциемия; инфекционные болезни; идиопатический |
| Острый некроз канальцев | |
| Постишемический | Все состояния, перечисленные выше для преренальной недостаточности |
| Пигментиндуцированный | Гемолиз (реакция на переливание крови, малярия); рабдомиолиз (травма, поражение мышц, кома, инфаркт сердца, тяжелая физическая нагрузка, истощение запасов калия или фосфора) |
| Токсининдуцированный | Антибиотики; рентгеноконтрастные средства; обезболивающие средства; тяжелые металлы; органические растворители |
| Связанный с беременностью | Септический аборт; маточное кровотечение; эклампсия |
Следует принимать во внимание возможность закупорки мочевых путей, что встречается у 1—10% больных с прогрессирующим снижением функции почек и часто бывает обратимым. Задержка мочи, происходящая в результате анатомической (поражение предстательной железы) или функциональной (органическая или индуцированная лекарственными средствами нефропатия) обструкции шейки мочевого пузыря, представляет собой сравнительно частую причину почечной недостаточности, и ее можно определить посредством пальпации надлобковой области и перкуссии или единичной катетеризации мочевого пузыря для определения объема остаточной мочи. Обструкция верхних отделов мочевых путей является более редкой причиной почечной недостаточности, поскольку для ее развития требуется одновременная обструкция обоих мочеточников или односторонняя обструкция мочеточника в случае, когда вторая почка отсутствует или подверглась тяжелому поражению. К числу причин двусторонней обструкции мочевых путей относятся болезнь Ормонда, опухоли, абсцессы, несчастный случай во время хирургической операции и двусторонняя окклюзия мочеточников (камни, ткань сосочков, кровяные тромбы или гной). Выявить постобструкционную почечную недостаточность помогут тщательное ректальное исследование и обследование тазовых органов. Обзорная рентгенограмма брюшной полости выявит процессы, локализующиеся в забрюшинном пространстве, или рентгеноконтрастные конкременты. Если обструкция верхних отделов мочевых путей не может быть исключена с помощью ультразвукового исследования, то дополнительную информацию дадут инфузионная урография, компьютерная томография или исследование проходимости мочеточников посредством ретроградной пиелографии. Нарушение тока мочи может произойти и в самих почках. Такая внутрипочечная обструкция обычно бывает обусловлена осаждением в просвете канальцев плохо растворимых веществ, таких как мочевая кислота (химиотерапия опухолей), щавелевая кислота (передозировка этиленгликоля, обезболивание при помощи метоксифлурана, анастомоз тонкой кишки), метотрексат (нерастворимые метаболиты), сульфаниламиды (с истекшим сроком годности, нерастворимые соединения пролонгированного действия) и, возможно, миеломные белки.
После того как пре- и постренальные нарушения будут исключены, целесообразно рассмотреть вопрос о возможности поражения сосудов почек — развития гломерулонефрита и интерстициального нефрита (см. табл. 219-1). Как часто эти болезни окажутся причиной прогрессирующего снижения функции почек, зависит от возраста больного. У взрослых только 5—10% всех случаев прогрессирующего снижения функции почек можно отнести на их счет, в то время как у детей эти болезни могут быть причиной подобного снижения в 40—60% случаев. Хотя эти болезни встречаются реже, чем острый некроз канальцев, часто они поддаются специфической коррекции, и их следует принимать во внимание в каждом случае снижения функции почек.
При первом осмотре больного терминальную стадию хронической почечной недостаточности можно ошибочно принять за острую почечную недостаточность. Чтобы избежать этого, врач должен иметь анамнез болезни пациента. Так, нефрогенная остеопатия, уремическая невропатия, маленький размер почек на рентгенограммах брюшной полости и необъяснимая анемия заставляют предположить наличие хронической почечной недостаточности. Однако при некоторых, характерных для терминальной стадии хронической почечной недостаточности заболеваниях, таких как амилоидоз, поликистоз почек, диабетический гломерулосклероз, склеродермия и быстропрогрессирующий гломерулонефрит, размеры почек могут быть нормальными или даже увеличенными, что потребует времени для длительного наблюдения за больным, а иногда и проведения биопсийного исследования почек, чтобы отличить потенциально обратимые формы острой почечной недостаточности от терминальной стадии хронической почечной недостаточности.
Наблюдение за особенностями тока мочи может помочь установить причины прогрессирующего снижения функции почек. Полная анурия (отсутствие мочи при катетеризации) редко наблюдается при остром некрозе канальцев. К числу возможных причин полной анурии относятся полная двусторонняя обструкция мочеточников, диффузный некроз коры почек, быстропрогрессирующий гломерулонефрит и двусторонняя окклюзия почечных артерий. Значительные колебания в суточных количествах мочи заставляют предположить наличие интермиттирующей обструктивной уропатии. Полиурия (более 3 л мочи в сутки) может быть признаком частичной обструкции мочевых путей. Полиурия является вторичной по отношению к сопутствующему нарушению концентрационной способности почек. Хотя олигурия (менее 400 мл мочи в сутки) считается основным признаком острой почечной недостаточности, у многих таких больных объем выделяемой мочи превышает 1 л в сутки. Такая ситуация получила название неолигурической острой почечной недостаточности.
Исследование осадка мочи представляет большую ценность при дифференциальной диагностике острых нарушений функции почек. Осадок, содержащий мало форменных элементов крови или только гиалиновые цилиндры, позволяет определенно предположить наличие преренальной азотемии или обструктивной уропатии. При остром некрозе канальцев более чем у 75% больных в осадке мочи наблюдаются коричневатые пигментированные клеточные цилиндры и большое число эпителиальных клеток почечных канальцев. Эритроцитарные цилиндры в осадке мочи наводят на мысль о наличии воспалительных процессов клубочков или сосудов почек, но они редко (или вообще никогда) присутствуют в осадке мочи при остром некрозе канальцев. Обнаружение большого числа полиморфно-ядерных лейкоцитов в виде одиночных клеток или их агрегатов позволяет предположить наличие острого диффузного интерстициального нефрита или некроза сосочков. Выявление эозинофильных цилиндров при окрашивании осадка мочи по Hansel помогает диагностировать острый аллергический интерстициальный нефрит. Сочетание коричневатых пигментированных зернистых цилиндров в осадке мочи и положительных результатов теста на наличие скрытой крови в моче в отсутствие гематурии указывает на гемоглобинурию, миоглобинурию. При острой почечной недостаточности выявление в свежей, теплой моче большого числа кристаллов мочевой кислоты позволяет предположить диагноз острой нефропатии, вызванной мочевой кислотой, в то время как присутствие большого числа кристаллов щавелевой или гиппуровой кислот наводит на мысль о токсическом действии этиленгликоля. Наличие большого числа широких цилиндров (диаметр которых превышает толщину 2—3 лейкоцитов) заставляет предположить диагноз хронической почечной недостаточности. Химический анализ состава мочи тоже может помочь отличить острый некроз канальцев от преренальной азотемии у больных, страдающих олигурией; результаты такого анализа представлены в табл. 219-2. Важно вспомнить о том, что при других заболеваниях, связанных с внезапным нарушением функции почек при сохранности почечных канальцев, таких как гломерулонефрит и ранняя фаза (несколько первых часов) обструктивной уропатии, химический состав мочи аналогичен таковому при преренальной азотемии. До введения мочегонных средств осмотический диурез, обусловленный гликозурией, бикарбонатурией и кетонурией, может помешать активной реабсорбции натрия и воды в почечных канальцах и тем самым изменить показатели химического состава мочи. Соотношение концентраций мочевой кислоты и креатинина, превышающее 1, может говорить и о том, что причиной острой почечной недостаточности является вызванная мочевой кислотой острая нефропатия.
Таблица 219-2. Данные химического анализа мочи при преренальной азотемии и острой почечной недостаточности
| Лабораторное исследование | Преренальная азотемия | Острая почечная недостаточность |
| Осмоляльность мочи (мосм/кг) | >500 | <400 |
| Содержание натрия в моче (ммоль/л) | <20 | >40 |
| Соотношение концентраций креатинина в моче и в плазме крови | >40 | <20 |
| Фракционная экскреция1 отфильтрованного натрия | <1 | |
| Осадок мочи | Обычный или содержащий гиалиновые и зернистые цилиндры | Коричневые зернистые цилиндры, обломки клеток |

Иногда причина прогрессирующего снижения функции почек неочевидна. В других случаях у больного отмечаются признаки, которые не считаются типичными для острого некроза канальцев (постепенное.начало почечной недостаточности; анурия в отсутствие обструктивной уропатии; выраженная гипертензия, протеинурия в тяжелой степени; значительная гематурия, скрытое системное заболевание и длительная олигурия). Поскольку подобные атипичные признаки могут указывать на потенциально излечимые формы поражения паренхимы почек, например, на врожденный сифилитический остеохондрит Вегенера, системную красную волчанку, синдром Гудпасчера или быстропрогрессирующий гломерулонефрит, то в тех случаях, когда причина почечной недостаточности неясна или имеются такие атипичные признаки, целесообразно провести диагностическое биопсийное исследование почек.
Клиническое течение. Клиническое течение при остром некрозе канальцев можно разделить на инициирующую фазу, фазу поддержания и фазу восстановления. Инициирующая фаза — это период времени между воздействием причинного фактора и проявлением острой почечной недостаточности, которую уже нельзя устранить при помощи изменения внепочечных факторов. Признание существования инициирующей фазы острой почечной недостаточности чрезвычайно важно, поскольку теоретически ранняя коррекция скрытой причины почечной недостаточности может предотвратить развитие фазы поддержания. Однако для клиницистов существование инициирующей фазы острой почечной недостаточности может стать очевидным только при ретроспективном анализе процесса, поскольку у них нет характерных признаков и симптомов.
Олигурия считалась главным отличительным признаком инициирующей и поддерживающей фаз острой почечной недостаточности. Однако проведенные в последнее время исследования заставляют предположить, что у 40—50% больных с острой почечной недостаточностью олигурия отсутствует (объем мочи более 400 мл/сут). Хотя протекающая без олигурии прогрессирующая острая почечная недостаточность может быть результатом поражения почек любого типа, включая как ишемическое, так и токсическое, однако эта форма острой почечной недостаточности, по-видимому, особенно часто развивается после нефротоксического воздействия лекарственных средств (например, аминогликозида). Прогрессирующая азотемия развивается у не страдающих олигурией больных в результате значительного снижения скорости клубочковой фильтрации и концентрационной способности почек. Например, максимальная осмоляльность мочи у не страдающих олигурией больных в среднем составляет только 350 моем на 1 кг воды. Следовательно, при выделении 1000 мл мочи в сутки может быть экскретировано ежесуточно не более 350 моем растворенных веществ. При острой почечной недостаточности суточная солевая нагрузка может увеличиться от нормальных значений в 600 моем до величины, превышающей 1000 моем. Таким образом, несмотря на суточное выделение 1 л мочи, у больного разовьются положительный солевой баланс (преимущественно мочевины и креатинина) и азотемия.
Олигурия служит характерным признаком фазы поддержания острой почечной недостаточности более чем в 50% случаев. Развивается олигурия вскоре после стимулирующего воздействия и длится в среднем 10—14 сут. Однако продолжительность олигурической фазы может быть как короче — всего несколько часов, так и длиннее — от 6 до 8 нед. Длительная олигурия обычно наблюдается у больных пожилого возраста, страдающих скрытым заболеванием сосудов. Если олигурия длится дольше 4 нед, то следует пересмотреть диагноз острого некроза канальцев и, возможно, допустить существование таких нарушений, как диффузный некроз коры почек, быстропрогрессирующий гломерулонефрит, окклюзия почечной артерии, почечный васкулит и сопутствующее снижение объема внеклеточной жидкости. Анурия нехарактерна для острого некроза канальцев. Однако тяжелая степень олигурии, продолжающейся в течение нескольких дней и характеризующейся объемом мочи менее 100 мл/сут, может быть обусловлена острым некрозом канальцев.
В инициирующей и поддерживающей фазах острой почечной недостаточности нарушается выведение из организма с мочой продуктов азотного обмена, воды, электролитов и кислот. Выраженность изменений, происходящих при этом в химическом составе крови, зависит от наличия олигурии, состояния катаболизма у больного. У не страдающих олигурией больных отмечают более высокие уровни клубочковой фильтрации, чем у больных с олигурией, и вследствие этого у первых с мочой экскретируется больше продуктов азотного обмена, воды и электролитов. Поэтому нарушения химического состава крови при острой почечной недостаточности у не страдающих олигурией больных обычно бывают слабее выражены, чем у страдающих олигурией.
У нелихорадящих, некатаболизирующих больных с олигурией при острой почечной недостаточности суточное увеличение концентрации азота мочевины в крови (АМК) и уровня содержания креатинина в сыворотке крови составляет в среднем соответственно 100—200 и 5—1 мг/л. У катаболизирующих больных, страдающих лихорадкой, сепсисом или обширной травмой, эти показатели могут достигать значений соответственно 400—1000 и 20—50 мг/л. У больных с острой почечной недостаточностью, обусловленной рабдомиолизом, суточное увеличение уровня содержания креатинина в сыворотке крови может быть непропорционально высоким по сравнению с увеличением концентрации АМК. Это обусловлено высвобождением из мышц креатина, который путем неферментного гидролиза превращается в креатинин.
Больные, страдающие острой почечной недостаточностью, сопровождающейся олигурией, составляют группу повышенного риска развития солевой и водной сверхнагрузки, приводящей к гипонатриемии, отеку и застою крови в легких. Гипонатриемия является следствием поступления в организм чрезмерного количества воды, а отек — чрезмерных количеств и воды, и натрия. Если не возмещать происходящих потерь воды с мочой у больных, не страдающих олигурией и обладающих сравнительно высокой скоростью тока мочи и концентрацией натрия в моче, то у них возможно резкое уменьшение объема внутрисосудистой жидкости, способное задержать восстановление функции почек.
Для острой почечной недостаточности характерна гиперкалиемия, обусловленная сниженной элиминацией калия почками при продолжающемся высвобождении его из тканей. Обычное суточное увеличение концентрации калия в сыворотке крови у не страдающих олигурией и подверженных катаболизму больных составляет 0,3—0,5 ммоль/сут. Большее суточное увеличение концентрации калия в сыворотке крови говорит о возможной эндогенной (деструкция тканей, гемолиз) или экзогенной (лекарственные средства, пищевой рацион, переливание крови) калиевой нагрузке или о высвобождении калия из клеток вследствие ацидемии. Обычно гиперкалиемия протекает бессимптомно до тех пор, пока концентрация калия в сыворотке крови не возрастает до значений, превышающих 6,0—6,5 ммоль/л. В случае превышения этого уровня наблюдаются изменения на электрокардиограмме (брадикардия, отклонение электрической оси сердца влево, остроконечные зубцы Т, расширение желудочковых комплексов, увеличение интервала Р—R и снижение амплитуды зубцов Р) и в конечном итоге может произойти остановка сердца. Гиперкалиемия может также привести к развитию мышечной слабости и вялого тетрапареза.
При острой почечной недостаточности наблюдаются также гиперфосфатемия, гипокальциемия и слабая степень гипермагниемии. Гиперфосфатемия является результатом снижения элиминации фосфора почками при продолжающемся высвобождении его из тканей. Концентрация фосфора в сыворотке крови обычно находится в диапазоне 60—80 мг/л, но у больных с травмой, высоким уровнем катаболизма, как и у больных, страдающих рабдомиолизом, уровни содержания фосфора в сыворотке крови могут быть значительно выше. Причина гипокальциемии с содержанием кальция в сыворотке крови в пределах 60—90 мг/л неясна. Гипермагниемия часто протекает бессимптомно, содержание магния в сыворотке крови при этом увеличивается до 20—30 мг/л. Подобное незначительное увеличение концентрации магния в сыворотке крови наблюдается до тех пор, пока не начинают применять магнийсодержащие лекарственные средства, такие как антациды.
Метаболический ацидоз — постоянный спутник острой почечной недостаточности. Суточное количество продуцируемых в ходе эндогенных обменных процессов нелетучих кислот, составляющее приблизительно 1 мэкв на 1 кг массы тела, не может долее элиминироваться поврежденными почками. В результате этого органические кислоты накапливаются в организме в количестве, достаточном для того, чтобы вызывать суточное снижение концентрации бикарбоната в плазме крови на 0,5—1 ммоль и развитие метаболического ацидоза с образованием анионного разрыва.
При острой почечной недостаточности часто развивается гиперурикемия с содержанием мочевой кислоты в сыворотке крови 90—120 мг/л, обусловленная снижением экскреции мочевой кислоты почками. У больных с высокой степенью катаболизма и обширным повреждением тканей уровни содержания мочевой кислоты в сыворотке крови могут быть и выше. Увеличение концентрации амилазы в сыворотке крови, обусловленное нарушением экскреции ее почками, может наблюдаться даже в том случае, если нет клинических признаков панкреатита. Степень увеличения концентрации амилазы невелика, и обычно она соответствует превышению верхних пределов нормальных значений меньше чем в 2 раза.
При острой почечной недостаточности изменяются гематологические показатели. Вскоре после развития значительной азотемии развивается нормоцитарная, нормохромная анемия, а гематокритное число стабилизируется на уровне 20—30 объемных процентов. Анемия обусловлена ослаблением эритропоэза, а также некоторым уменьшением продолжительности жизни эритроцитов. К числу дополнительных факторов, вносящих свой вклад в развитие анемии, относятся гидремия, потеря крови через пищеварительный тракт и угнетение эритропоэза вследствие инфекционного заболевания или введения лекарственных средств. Продуцирование лейкоцитов не претерпевает серьезных изменений, однако поскольку острая почечная недостаточность развивается, как правило, в условиях стресса и повреждения тканей, то у больного наблюдается слабый лейкоцитоз. Если содержание лейкоцитов не нормализуется и после 1-й недели развития острой почечной недостаточности, это позволяет предположить наличие у пациентов инфекционного заболевания. В ранних стадиях острой почечной недостаточности может наблюдаться слабая степень тромбоцитопении, обусловленная снижением выработки тромбоцитов в костном мозге. Развиваются качественные нарушения функции тромбоцитов, которые в сочетании с дополнительными плохо выявляемыми нарушениями свертываемости крови вносят свой вклад в развитие тенденции к кровоточивости. Острая почечная недостаточность может развиться в результате внутрисосудистого гемолиза, а также быть осложнением нескольких первичных гематологических или сосудистых заболеваний, сопровождающихся такими серьезными явлениями, как диссеминированная внутрисосудистая коагуляция, тромботическая тромбоцитопеническая пурпура, гемолитико-уремический синдром и системная красная волчанка.
Инфекционные болезни осложняют течение острой почечной недостаточности у 30—70% больных и рассматриваются как ведущая причина смертности. Воротами инфекции чаще служат дыхательные пути, места проведения хирургических операций и мочевые пути. При этом часто развивается септицемия, вызываемая как грамположительными, так и грамотрицательными микроорганизмами. Абсцессы, возникающие в местах выполнения хирургических операций (особенно в брюшной полости), обусловливают неблагоприятный прогноз в том случае, если они не будут своевременно выявлены, а больным не будет оказано соответствующего лечения. Хотя еще предстоит точно определить факторы, ответственные за высокую частоту развития инфекционных осложнений, определенную роль в их возникновении может играть нарушение целостности анатомических барьеров при внутривенных вливаниях и введении постоянных катетеров. Имеются также данные о нарушении при уремии защитных механизмов организма-хозяина, включая дисфункцию лейкоцитов. Особенно важно для больных с острой почечной недостаточностью свести к минимуму использование постоянных катетеров и линий для внутривенного вливания, проводить тщательный ежедневный осмотр и дать своевременную точную оценку причин развившейся лихорадки. Важно также подчеркнуть, что уремия может маскировать лихорадку, вызванную развитием инфекционного заболевания.
К числу сердечно-сосудистых осложнений острой почечной недостаточности относятся недостаточность кровообращения, гипертензия, аритмии и перикардит. Недостаточность кровообращения развивается в результате введения в организм чрезмерно больших количеств натрия и воды. Слабая гипертензия наблюдается у 15—25% больных и проявляется обычно через 7—9 дней после начала олигурии. Часто она служит проявлением чрезмерного увеличения объема внеклеточной жидкости; однако в некоторых случаях в развитие гипертензии может вносить вклад и повышение активности системы ренин—ангиотензин у 20—JU% больных. Острая почечная недостаточность осложняется наджелудочковыми аритмиями, к числу известных причин возникновения которых относятся застойная сердечная недостаточность, нарушение электролитного баланса, интоксикация препаратами наперстянки, перикардит и анемия. В настоящее время перикардит развивается редко, возможно, благодаря раннему применению диализной терапии.
Острая почечная недостаточность часто сопровождается неврологическими нарушениями. У больных, не находящихся на диализе, наблюдаются летаргия, сонливость, помутнение сознания, дезориентировка, «порхающее» дрожание, тревожное возбуждение, миоклонические подергивания мышц и судорожные припадки. В большей степени они характерны для больных пожилого возраста и хорошо поддаются коррекции при диализной терапии. Помимо собственно уремии, в качестве потенциальных причин неврологических нарушений у больного с острой почечной недостаточностью необходимо рассматривать такие факторы, как введение лекарственных средств, нарушение обмена веществ и электролитного баланса, а также наличие первичного неврологического заболевания.
Острой почечной недостаточности часто сопутствуют осложнения со стороны желудочно-кишечного тракта, к числу которых относятся анорексия, тошнота, рвота, непроходимость кишечника и неопределенные жалобы на дискомфорт в брюшной полости. Сочетание возникшего в результате острого заболевания стресса и гемостатических нарушений у 10—30% больных приводит к развитию незначительных и легко контролируемых с помощью консервативной терапии желудочно-кишечных кровотечений. Было показано, что внутривенное введение 1-деамино-8-аргинин-вазопрессина (ДАВП, внутривенно в дозе 0,4 мкг/кг) уменьшает время кровотечения и улучшает гемостаз у некоторых больных с острой почечной недостаточностью. В случае, если ДАВП неэффективен, целесообразно использовать криопреципитат.
Когда скорость клубочковой фильтрации увеличивается настолько, что прекращается дальнейшее увеличение концентрации АМК и содержания креатинина в сыворотке крови, говорят о начале фазы восстановления острой почечной недостаточности. При олигурической острой почечной недостаточности предвестником наступления фазы восстановления служит прогрессирующее увеличение объема выделяемой мочи. В первые дни объем выделяемой мочи увеличивается в 2 раза за сутки, а в некоторых случаях уже через несколько дней может быть достигнут суточный объем мочи, превосходящий 2 л. У не страдающих олигурией больных выраженной диуретической фазы обычно не наблюдается. Продолжительность фазы восстановления у тех больных, концентрация АМК и содержание креатинина в сыворотке крови которых превышают соответственно 500 и 50 мг/л, составляет в среднем 15—25 сут у страдающих олигурией больных и 5—10 сут у не страдающих олигурией. Основные осложнения острой почечной недостаточности, такие как инфекционные болезни, желудочно-кишечные кровотечения, нарушение баланса жидкости и электролитов и нарушение функции сердечно-сосудистой системы, могут быть стойкими или впервые проявиться во время фазы восстановления. Кроме того, существующие стойкие нарушения функции клубочков и канальцев могут привести во время этой фазы к развитию гипер- или гипогидратации или к нарушению баланса электролитов, если в этот период времени не будут осуществляться тщательное ежедневное определение массы тела больного, количества поступающей в организм и выделяемой жидкости, биохимическое и клиническое контролирование состояния больного. У больных с рабдомиолизом во время фазы восстановления может развиться гиперкальциемия, причина которой остается неясной. Хотя основное улучшение функции почек происходит в течение первых 1-2 нед фазы восстановления, дальнейшая ее нормализация продолжается в течение года после заболевания. Результаты чувствительных тестов функции клубочков и канальцев позволяют также предположить, что некоторые небольшие дефекты в функционировании почек могут сохраняться неопределенно долго после острого некроза канальцев. Однако у подавляющего большинства больных функция почек восстанавливается и не имеется свидетельств о развитии у них в дальнейшем какой-либо дисфункции органа или таких осложнений, как гипертензия.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 537; Нарушение авторских прав?; Мы поможем в написании вашей работы!