
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сумісне відновлення оксидів металів воднем
|
|
|
|
Отримання порошків сплавів
Цей метод застосовують у тих випадках, коли метали, що входять до складу сплаву, мають низьку спорідненість з киснем, наприклад Cu, Fe, Co, Ni, Mo, W. Можливе також сумісне відновлення оксидів металів комбінованим відновником з додаванням вуглецю.
Термодинамічні особливості отримання порошків сплавів майже такі самі, як і в разі отримання порошків окремих металів відновленням воднем, вуглецем, хоч у цьому випадку на константу рівноваги впливають активності металів сплаву.
Оскільки молібден і залізо утворюють тверді розчини, то в процесі відновлення, за низьких температур можуть виникати такі біваріантні системи рівноваги:
0,5 MoO2 + H2 = 0,5 Mo + H2O (4.11)
0,25 Fe3O4 + H2 = 0,75 Fe + H2O (4.12)
Для реакції (4.11) – це твердий розчин (Fe-M0)-M0O2 – газова фаза і для реакції (4.12) – твердий розчин (Fe-M0)-Fe3O4 – газова фаза. Константу рівноваги реакції (4.11) визначають із співвідношення:
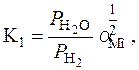
де  – активність молібдену, що визначається за формулою
– активність молібдену, що визначається за формулою
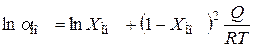 ;
;
Q – енергія змішування молібдену і заліза для твердого розчину, яка дорівнює 25 кДж/моль;  – молярна частка молібдену в твердому розчині Fe–Mо. Для реакції (4.12) константа рівноваги
– молярна частка молібдену в твердому розчині Fe–Mо. Для реакції (4.12) константа рівноваги

де  – активність заліза у твердому розчині, що визначається за формулою
– активність заліза у твердому розчині, що визначається за формулою

де  – молярна частка заліза у твердому розчині Mо–Fe.
– молярна частка заліза у твердому розчині Mо–Fe.
Значення констант рівноваги для вказаних систем наведено у табл. 4.2.
Аналіз термодинамічних характеристик у розглянутому випадку дозволяє зробити висновок про те, що в разі сумісного відновлення оксидів заліза і молібдену передусім відновлюються оксиди заліза. Оксиди молібдену починають відновлюватись після появи металевого заліза. Кінетичні закономірності процесу відновлення бінарної оксидної системи Fe2O3 – MоO2 показано на рис. 4.12.
Таблиця 4.2
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 833; Нарушение авторских прав?; Мы поможем в написании вашей работы!