
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Відновленням
|
|
|
|
Отримання порошків металів металотермічним
В основі процесів отримання порошків металів металотермічними методами лежить реакція:
Ме Х + Ме^ = Ме + Ме Х + О. (4.10)
Як вихідні сполуки (Ме Х) застосовують оксиди, хлориди, фториди. Інтенсивність і повнота реакції відновлення залежить від спорідненості металу-відновника Ме^ і відновлюваного металу М з киснем, хлором і фтором. Чим вища спорідненість металу-відновника із цими елементами, тим інтенсивніше і більш повно проходить реакція відновлення. Спорідненість елементів у певній сполуці визначається ізобарно-ізотермічним потенціалом 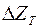 реакції (4.10).
реакції (4.10).
Аналіз даних, що є в літературі, свідчить про те, що відновниками для оксидів, хлоридів, фторидів можуть слугувати кальцій, магній, натрій і алюміній. При цьому для відновлення оксидів можна застосовувати Са, Mg і Al, для хлоридів – Ca, Na, Mg, для фторидів – Ca, Na, Mg.
Характеристики металів-відновників і їх сполук з киснем, хлором і фтором наведено у табл. 4.1
У кожному конкретному випадку, вибираючи відновника, виходять із такого:
1) відновник має бути більше спорідненим з металоїдом (О2; Cl; F), ніж відновлюваний елемент;
2) відновник не має взаємодіяти зі сполукою, що відновлюється, і відновленим металом;
3) продукти відновлення мають легко відокремлюватись один від одного методами механічного чи хімічного збагачення;
4) частинки відновленого металу, що утворились, не повинні спікатись чи утворювати конгломерати.
Таблиця 4.1
Характеристики металів-відновників
| Елемент | Метали | Оксиди | Хлориди | Фториди | ||||
| Температура, °С | ||||||||
| Na | 97,7 | - | ||||||
| Ca | - | |||||||
| Mg | - | |||||||
| Al | - | 192,4 |
У табл. 4.1 позначено: 1 – температура плавлення, 2 – температура кипіння.
Найповніше відповідає цим вимогам кальцій, який не утворює з багатьма металами сполук, сплавів і твердих розчинів. Крім того, оксид кальцію, що утворився, легко відокремлюється від отриманого продукту гідрометалургійною переробкою.
Однак застосування кальцію як відновника не завжди доцільне, оскільки для отримання якісних сумішей з вихідними оксидами потрібні дисперсні порошки кальцію, під час виробництва, транспортування й зберігання яких виникає загроза спалаху чи вибуху. Тому в порошковій металургії частіше використовують для відновлення такі оксиди, як ТіО2, ZrO2 i ThO2 та гідрид кальцію, який отримують взаємодією кальцію із сухим і чистим воднем за температури 400…500 °С. Гідрид кальцію має підвищену крихкість і легко подрібнюється в порошок. Застосування як відновника гідриду кальцію вигідне ще й тому, що в процесі відновлення поряд з кальцієм бере участь атомарний водень, що утворюється в результаті розпаду СаН2 за температури вищої за 800 °С і має високу відновлювальну здатність. Це зумовлено тим, що спорідненість атомарного водню з киснем вища, ніж з кальцієм і магнієм. Так, теплота утворення пари води з атомарного водню і кисню дорівнює 722 кДж, тоді як у стандартних умовах теплота утворення моля СаО і МоО становить відповідно 634,2 і 604,8 кДж.
Магній і натрій, хоч і мають досить високу спорідненість з киснем і галогенами у практиці металотермічного відновлення, особливо оксидів металів, застосовують рідше. Магній утворює з киснем оксид, майже не розчинний у воді та слабких розчинах кислот, що значно утруднює процес його відділення від відновленого металу. Застосування натрію для відновлення оксидів утруднено через його високу активність і підвищену пружність парів за температур відновлення. У зв’язку з цим магній і кальцій застосовують здебільшого для відновлення галоїдних солей металів.
Важливе значення для металотермічного відновлення металів має тепловий ефект реакцій, співвідношення якого до одиниці маси шихти називають термічністю процесу:
 ,
,
де Q – тепловий ефект реакції; М сп – молярна маса відновної сполуки; А Ме^ – атомна маса металу-відновника.
Звичайно, термічність спонтанного процесу має бути не меншою за 2090 кДж/кг вихідної шихти. При цьому термічність значною мірою залежить від співвідношення мас відновної сполуки та металу-відновника. Найвищі її значення має стехіометричне співвідношення. Надлишок того чи іншого компонента у вихідній шихті призводить до зниження термічності, оскільки для цього випадку потрібна витрата теплоти на нагрівання, а в разі застосування до металу-відновника і плавлення – надлишкового компонента. Крім того, на термічність процесу впливають умови теплопередачі, ступінь гомогенності шихти, розміри частинок вихідних компонентів та ін. Наприклад, зменшення розміру частинок і збільшення ступеня гомогенності за інших рівних умов зумовлює підвищення термічності за рахунок збільшення контактної поверхні між компонентами шихти.
Якщо теплоти, що виділяється, недостатньо для спонтанного проходження процесу, що часто спостерігається в реальних умовах, у шихту можна вводити сильні окисники і легковідновлювальні оксиди, селітру, бертолетову сіль та інші солі, взаємодія яких з металом-відновником супроводжується сильним екзотермічним ефектом. Тоді термічність процесу можна визначати за рівнянням
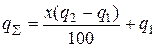 ,
,
де Х – вміст домішки, %; q 2 – термічність реакції взаємодії домішки з металом-відновником; q 1 – термічність реакції відновлення основного оксиду металу.
Якщо введення домішки, що збільшує екзотермічний ефект реакції, з яких-небудь причин небажане (забруднення отриманого металу, трудність розділення продуктів реакції), застосовують зовнішнє підігрівання шихти (реактор з шихтою поміщають у піч).
Однак збільшувати термічність не завжди потрібно для розроблення процесу відновлення. Іноді термічність треба обмежувати через бурхливий перебіг реакції і застосовувати герметичні реактори. У цьому разі для зниження термічності процесу у вихідну шихту вводять інертні домішки – оксиди металів-відновників, наприклад СаО, чи порошки відновлюваних металів.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 577; Нарушение авторских прав?; Мы поможем в написании вашей работы!