
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 1 5. Законы идеальных газов
|
|
|
|
15.1 Макроскопические состояния
| Число молей вещества: ν = m/M; ν = V/VM, где m – масса; M - молярная масса; V – объем, VM – молярный объем. |
| Масса одной молекулы: m0= M/NA; m0 = ρ/n, где М – молярная масса, NA = 6,023·1023 моль-1 - число Авогадро; ρ - плотность; n0 - концентрация, определяется из соотношений: n0 = N/V; n = ρ/m0; n = NA/M. |
| Число молекул в данной массе вещества: N = m/m0 = m Na/M. |
| Термодинамическая температура связана с температурой шкалы Цельсия T ,K = t°C +273,15; t°C = T,K – 273,15°С |
9.2 Уравнения состояния идеального газа. Изопроцессы
| Уравнения состояния идеального газа (уравнение Менделеева –Клапейрона): для одного моля газа; pVм = RT - для произвольной массы газа: pV = mRT/M; pV = νRT - где Vм - молярный объем; M - молярная масса; m – масса газа; ν = m/M -количество вещества; R – универсальная газовая постоянная |
| Объединенный газовый закон (уравнение Клапейрона): pV/T =const; p1V1/T1 = p2V2/T2 где p –давление газа; V –объем; T – термодинамическая температура |
| Закон Бойля –Мариотта (изотермический процесс): pV = const; p1V1= p2V2 при T=const, m = const |
| Закон Гей-Люссака (изобарический процесс): V =V0(1 + αt) или V/T =const; V1/V2= T1/T 2 при p =const, m =const Закон Шарля (изохорический процесс): р= р0(1 + αt) или p/T =const; p1/p2 = T1/T2 при V =const, m =const, где t –температура по шкале Цельсия, V0, p0 –соответственно объем и давление при 00С, коэффициент α =1/273 К-1, p, V, T соответственно давление, объем и термодинамическая температура |
Закон Дальтона для давления смеси n идеальных газов: p = 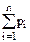 ,
где pi - парциальное давление i -ой компоненты газа ,
где pi - парциальное давление i -ой компоненты газа
|
| Закон Авогадро: при Т0 = 00С =273 К, р0 =1 атм =1,013·105 Па мольный объем любого газа Vм =22,4 л ·моль-1 = 2,24·10-2 м3·моль-1 |
Пример 20. В двух баллонах имеются два газа: водород – Н2 и углекислый газ – СО2. Во сколько раз число молекул одного газа больше числа молекул другого газа, если массы газов одинаковы?
Условие:
М1 =2·10-3 кг/моль;
М2 =44·10-3 кг/моль;
N1/N2 -?
Решение. В одном моле вещества содержится число молекул, равное числу Авогадро N =6,02·1023 моль-1. Количество вещества водорода ν = m/M1, а в углекислом газе содержиттся число молей ν2 = m/M2. Тогда число молекул водорода N1 = ν1NA = mNA/M1, число молекул углекислого газа N2 = ν2NA = mNA/M2.
Разделив N1 на N2, получим ответ
N1/N2 = M2/M1 = 44/2 = 22
Пример 21. В баллоне объемом V = 10 л находится гелий под давлением р1 = 1 МПа и при температуре Т1 = 300 К. После того, как из баллона было взято m = 10 г гелия, температура в баллоне понизилась до Т2 = 290 К. Определить давление р2 гелия, оставшегося в баллоне, и изменение внутренней энергии газа.
Условие:
V = 10 л = 10-2 м3;
р1 = 1,0 МПа = 1,0·106 Па;
Т1 = 300 К;
m = 10 г = 1,0·10-2 кг;
Т2 = 290 К;
R = 8,314 Дж/кг·К;
М = 4·10-3 кг/моль;
р2 -? U -?
Решение. Воспользуемся уравнением Менделеева-Клапейрона, применив его к конечному состоянию газа:
р2V = m2RT2/M, (1)
где m2 – масса гелия в конечном состоянии;
М – молярная масса гелия;
R – универсальная газовая постоянная.
Из уравнения (1) выразим искомое давление
р2 = m2RT2/MV. (2)
Массу m2 гелия выразим через массу m1, соответствующую начальному состоянию, и массу m гелия, взятого из баллона:
m2 = m1 – m. (3)
Массу m1 гелия найдем также из уравнения Менделеева- Клапейрона, применив его к начальному состоянию:
m1 = Mp1V/RT1. (4)
Подставив выражение массы m1 в уравнение (2), а затем выражение m2 в уравнение (1), найдем
p2 = (Mp1V/RT1 – m)RT2/MV, (5)
 .
.
Формула (5) дает единицу давления
[p] = К·Па/К – кг · Дж · К · моль/(кг · моль · м3·К) =
= Па – Дж/м3 = Па – Н·м/м3 = Па.
Вычисления
р2=290·106/300 – 1,0·10-2·8,314·290/(4·10-3·10-2) = 3,64·105 Па.
Внутренняя энергия газа в исходном состоянии
U1 = m1iRT1/2M.
Для газа, оставшегося в баллоне
U2 = m2 iRT2/2M.
Изменение энергии газа
U = U1 – U2 = R(m1 – m2) (T1 – T2)/M = Rm (T1 – T2)/M.
Проверка размерности: [U] = Дж·кг·К·моль/моль·К·кг = Дж.
Ответ: U = 208 Дж.
ЗАДАНИЕ 16. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНОГО ГАЗА
16.1 Идеальный газ как модельная термодинамическая система. Статистические распределения
| Основное уравнение молекулярно-кинетической теории газов: p = n0m<v2кв>/3; p = ρ<v2кв>/3; p =2n<ε>/3; <ε> = m<vкв2>/2, где <vкв > -средняя квадратичная скорость молекул; <ε> - средняя кинетическая энергия поступательного движения молекулы; n0 –концентрация молекул; m - масса одной молекулы; ρ - плотность газа |
| Закон Максвелла для распределения молекул идеального газа по скоростям: f(v) = dN(v)/Ndv = 4π (m0/2πkT)3/2v2exp [ - m0v2/2kT], где функция f(v) распределения молекул по скоростям определяет число молекул dN(v)/N из общего числа молекул, скорости которых лежат в интервале от v до v+dv |
| Барометрическая формула: p = p0 exp [ - Mg (h – h0)/RT]; p = p0exp[ - m0g(h – h0)/kT], где р и р0 – давление газа на высоте h u h0, M - молярная масса газа, m0 -масса молекулы, R - универсальная газовая постоянная, k - постоянная Больцмана Распределение Больцмана во внешнем центральном поле: n = n0 exp [ -Mgh/RT]; n = n0 exp [-m0gh/kT]; n = n0exp[- Wп/kT], где n, n0 -концентрация молекул на высоте h и h0=0; Wп - потенциальная энергия молекул в поле тяготения |
| Скорости молекул: наиболее вероятная: vb = (2RT/M)1/2 = (2kT/m0)1/2 = (2p/ρ)1/2 средняя квадратичная: <vкв> =(3RT/M)1/2= (3kT/ m0)1/2 =(3p/ρ)1/2 средняя арифмeтическая: <v> = (8RT/πM)1/2 =(8kT/πm0)1/2= (8p/πρ)1/2 где T - абсолютная температура газа; M - молярная масса газа; m0 – масса одной молекулы; p - давление газа; ρ – плотность газа; R – универсальная газовая постоянная; k – постоянная Больцмана |
| Средняя кинетическая энергия поступательного движения молекулы: <εk> =3kT/2. Средняя полная энергия молекулы: <εk> = ikT/2, где i- число степеней свободы молекул; k – постоянная Больцмана; T –термодинамическая температура одноатомный газ: i =3; двухатомный газ: i=5; многоатомный газ: i =6. |
| Зависимость давления газа от температуры: p = nkT |
Пример 22. Температура окиси азота NO Т =300 К. Определить долю молекул, скорости которых лежат в интервале от v1 = 820 м/с до v2 = 830 м/с
| Условие: Т = 300 К; v1 = 820 м/с; v2 = -830 м/c; ∆N /N -? | 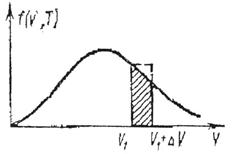
|
Решение. Рассматриваемый газ находится в равновесном состоянии, и согласно Максвеллу, относительное число молекул, скорость которых заключена в интервале от v до v + dv
ΔN/N = f (v, T)dv,
где f (v, T) – функция Максвелла;
dv – настолько малый диапазон скоростей, что в пределах его заведомо f (v, T) = const.
В условии задачи требуется определить долю молекул, скорости которых лежат в диапозоне ∆v = v2 – v1 = 10 м/с.
Если в этом пределе функцию Максвелла можно считать с достаточной точностью постоянной, то искомая величина может быть рассчитана по приближенной формуле
∆N/N = f (v1, N)∆v. (1)
Такое приближение соответствует тому, что на рис. 6 заштрихованная площадь приравнивается к площади прямоугольника с основанием v1 и высотой, равной значению f (v, T).
Следовательно, прежде всего надо найти значения функции Максвелла при v = v1 и v = v2 и выяснить, какую погрешность может дать использование равенства (1).
Функция Максвелла имеет вид
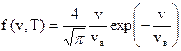 , (2)
, (2)
где vв = (2kT/m0)1/2 = (2RT/M)1/2 - (3)
- наиболее вероятная скорость молекул
Для облегчения расчета найдем сначала наиболее вероятную скорость по равенству (3) vb = 410 м/с.
Тогда согласно (2)
f(v1,T) = 4,03·10-4 c/м f(v2, T) = 3,75·10-4 c/м.
Это означает, что при использовании выражения (23) допускается ошибка относительная величина которой
δf = [f(v1, T) – f (v2, T)]/f (v1, T) = 0,07 = 7%.
Следовательно, с указанной степенью точности можно использовать равенство (2). Тогда доля молекул, скорости которых лежат в заданном интервале
ΔN/N = f (v1, T)∆v = 4,0 ∙ 10-3 = 0,4%.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 424; Нарушение авторских прав?; Мы поможем в написании вашей работы!